题目内容
科学家曾用人工合成的甲基丁香酚涂在纸片上,挂在柑桔园里诱得大量雄性柑桔果蝇并加以消灭,这是下列哪种信息在生产上的应用
- A.物理信息
- B.行为信息
- C.化学信息
- D.营养信息
解析:
化学物质传递信息,属于化学信息。

| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
回答下列问题:
(1)该反应在较低温度下能否自发进行?
(2)从323K到353K,氨气的生成量减少的原因
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;
(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
| 4 |
| 7 |
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为
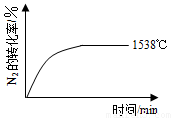
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g)2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0、86×10-4 | 2、6×10-4 | 64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H22NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(4)合成氨的反应N2(g)+3H2(g)2NH3(g) △H =-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2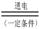 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g)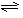 2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0、01(填大于、等于或小于)。
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.