题目内容
晶体是内部微粒(原子、离子或分子)在空间按一定规律做_____构成的_______物质,晶体区别于非晶体的三个特征:具有______的几何外形,各向________和具有特定的_______。
周期性重复排列;固体;规则;异性;对称性

练习册系列答案
相关题目
有关化学键和晶体的说法中正确的是( )
| A、离子键的本质是静电作用,阴阳离子电荷越大、离子半径越小,静电作用越强 | B、共价键的本质是共用电子对,因此必须由成键的两原子各提供一个电子形成 | C、分子晶体的基本微粒是分子,分子晶体熔沸点由分子内部共价键强弱决定 | D、原子晶体由于是空间网状结构,因此只能由碳、硅两元素构成 |
[物质结构与性质]
(1)A、B、C为短周期元素,请根据下表信息回答问题.
①第一电离能:A B(填“>”、“<”或“=”),基态C原子的电子排布式为 .
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为 .
(2)发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目取得积极进展.已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH)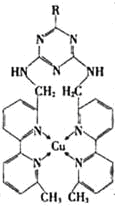 ,从而实现液化.
,从而实现液化.
①某含铜的离子结构如图所示,在该离子内部微粒间作用力的类型有 .
a.离子键 b.极性键 c.非极性键 d.配位键 e.范德华力 f.氢键) (填字母)
②煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键.请你说明甲醛分子间没有氢键原因 ;
③甲醇分子中进行sp3杂化的原子有 ;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为 .
(1)A、B、C为短周期元素,请根据下表信息回答问题.
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为
(2)发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目取得积极进展.已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH)
 ,从而实现液化.
,从而实现液化.①某含铜的离子结构如图所示,在该离子内部微粒间作用力的类型有
a.离子键 b.极性键 c.非极性键 d.配位键 e.范德华力 f.氢键) (填字母)
②煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键.请你说明甲醛分子间没有氢键原因
③甲醇分子中进行sp3杂化的原子有
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC__________Si; SiCl4___________SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?____________(填“能”或“不能”),理由是___________________(提示对比二者晶体类型及内部微粒作用力)
(3)如右图立方体中心的“·”表示金刚石晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的碳原子;

(4)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为______________________(要包含数据和焓变单位)