题目内容
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.
(1)写出NaCl的电子式 .
(2)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH反应,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为 .
(3)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①经精制的饱和NaCl溶液应从图中电解池的 (填写“左”或“右”)池注入.
②图中X是 (填化学式);图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母).
A.a%=b% B.a%>b% C.a%<b%
③上述设计的主要优点有(写出一个方面) .
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
下列说法中,不正确的是 (填字母).
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
e.NaHCO3溶液中c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
(1)写出NaCl的电子式
(2)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH反应,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为
(3)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①经精制的饱和NaCl溶液应从图中电解池的
②图中X是
A.a%=b% B.a%>b% C.a%<b%
③上述设计的主要优点有(写出一个方面)
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 5.2 |
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
e.NaHCO3溶液中c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
考点:氯碱工业,电解原理
专题:电化学专题
分析:(1)NaCl为离子化合物,书写氯离子时注意用中括号;
(2)根据反应物和生成物写出反应方程式;
(3)①根据物质的转化情况,电解池的左池是可以得到氢氧化钠来判断饱和NaCl溶液的进入情况;
②在燃料电池中,所以通入空气的极是正极,氧气发生得电子的还原反应,通入燃料的极是负极,氢氧燃料电池最后产生的是水,能将电解质稀释,据此回答判断;
③从物质的循环利用角度来分析;
(4)a、根据氯气和水的反应平衡移动的影响因素来回答;
b、盐的水解都对水的电离起到促进作用,水解规律:越弱越水解;
c、酸的酸性越强,则pH越小,酸的电离平衡常数可以反映酸的强弱;
d、根据亚硫酸氢钠溶液显示酸性,则阴离子的电离程度大于其水解程度,据此回答判断;
e、通过对碳酸氢钠溶液进行电荷守恒和物料守恒列式即得.
(2)根据反应物和生成物写出反应方程式;
(3)①根据物质的转化情况,电解池的左池是可以得到氢氧化钠来判断饱和NaCl溶液的进入情况;
②在燃料电池中,所以通入空气的极是正极,氧气发生得电子的还原反应,通入燃料的极是负极,氢氧燃料电池最后产生的是水,能将电解质稀释,据此回答判断;
③从物质的循环利用角度来分析;
(4)a、根据氯气和水的反应平衡移动的影响因素来回答;
b、盐的水解都对水的电离起到促进作用,水解规律:越弱越水解;
c、酸的酸性越强,则pH越小,酸的电离平衡常数可以反映酸的强弱;
d、根据亚硫酸氢钠溶液显示酸性,则阴离子的电离程度大于其水解程度,据此回答判断;
e、通过对碳酸氢钠溶液进行电荷守恒和物料守恒列式即得.
解答:
解:(1)NaCl为离子化合物,有钠离子与氯离子构成,电子式为: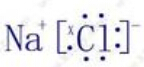 ,故答案为:
,故答案为: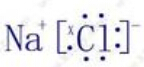 ;
;
(2)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为 NaCl+H2O
NaClO+H2↑,故答案为:NaCl+H2O
NaClO+H2↑;
(3)①根据物质的转化情况,电解池的左池是电解食盐水得到的氢氧化钠,所以经精制的饱和NaCl溶液应从图中电解池的左池进入,故答案为:左;
②在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%小于b%,故答案为:Cl2;C;
③上述方案的优点之一是实现了实现了氢气的循环利用,故答案为:实现了氢气的循环利用;
(4)a、向氯水中加入NaHCO3,可以和盐酸之间反应,促使氯气和水的反应平衡正向移动,增大氯水中次氯酸的浓度,故a正确;
b、四种溶液中,盐中酸根离子水解程度越大,则水的电离程度越大,碱性越强,水解程度越大,即水的电离程度最大的是Na2CO3,故b错误;
c、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,酸性顺序是:H2SO3>H2CO3>HClO,pH最大的是HClO,故c错误;
d、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故d错误;
e、在NaHCO3溶液中,根据电荷守恒可得:C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①
根据物料守恒可得:C(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)②
将①②联立可得:c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故e正确.
故选bcd.
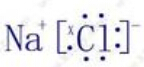 ,故答案为:
,故答案为: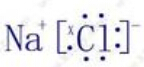 ;
;(2)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为 NaCl+H2O
| ||
| ||
(3)①根据物质的转化情况,电解池的左池是电解食盐水得到的氢氧化钠,所以经精制的饱和NaCl溶液应从图中电解池的左池进入,故答案为:左;
②在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%小于b%,故答案为:Cl2;C;
③上述方案的优点之一是实现了实现了氢气的循环利用,故答案为:实现了氢气的循环利用;
(4)a、向氯水中加入NaHCO3,可以和盐酸之间反应,促使氯气和水的反应平衡正向移动,增大氯水中次氯酸的浓度,故a正确;
b、四种溶液中,盐中酸根离子水解程度越大,则水的电离程度越大,碱性越强,水解程度越大,即水的电离程度最大的是Na2CO3,故b错误;
c、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,酸性顺序是:H2SO3>H2CO3>HClO,pH最大的是HClO,故c错误;
d、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故d错误;
e、在NaHCO3溶液中,根据电荷守恒可得:C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①
根据物料守恒可得:C(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)②
将①②联立可得:c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故e正确.
故选bcd.
点评:本题考查学生氯碱工业的有关知识,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列说法错误的是( )
| A、现代化学分析测试中用原子吸收光谱确定物质中含有哪些金属元素 |
| B、海水中碘的总藏量很大,所以工业上直接由海水提取碘 |
| C、稀的硫酸铜溶液可用于治疗鱼类皮肤病和鳃病 |
| D、早在1000多年前,我国就已采用加热绿矾的方法制取硫酸 |
某电化学实验装置如图所示,下列说法正确的是( )


| A、若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B、若X为碳棒,开关K置于N处,转移0.2mol e-时析出0.1mol O2 |
| C、若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D、若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e-=Zn2+ |
常温下,下列溶液中各组离子一定能大量共存的是( )
| A、使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、CO32- | ||
| B、由水电离产生的c(H+)=10-12mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- | ||
| C、含有0.1 mol?L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SCN- | ||
D、
|
