题目内容
2013年底至2014年初,雾霾天气多次肆虐北京、上海等多个地区.其中,燃煤和工厂废气乱排是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
2CO2(g)+N2(g)△H<0;该反应平衡常数表达式 .
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ?mol-1
H2O(g)═H2O(l)△H=-44.0kJ?mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 .
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
| 催化剂 |
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ?mol-1
H2O(g)═H2O(l)△H=-44.0kJ?mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式
考点:热化学方程式,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
解答:
解:(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,故答案为:K=
,
故答案为:
;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol;
| C2(CO2)?C(N2) |
| C2(NO)?C2(CO) |
故答案为:
| C2(CO2)?C(N2) |
| C2(NO)?C2(CO) |
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol;
点评:本题考查了化学平衡常数的表达式的书写、盖斯定律求焓变的计算应用,注意所给的条件是解题关键,题目难度不大.

练习册系列答案
相关题目
下列关于有机物的命名正确的是( )
| A、2-甲基-3-丁醇 |
| B、2,2-甲基丁烷 |
| C、2-乙基-1-丁烯 |
| D、间甲苯 |
已知某有机物的结构简式为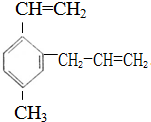 .下列说法中不正确的是( )
.下列说法中不正确的是( )
 .下列说法中不正确的是( )
.下列说法中不正确的是( )| A、该有机物使溴的四氯化碳溶液褪色和在FeCl3作用下与液溴反应的原理一样 |
| B、1mol该有机物完全燃烧需消耗15.5mol O2 |
| C、该有机物在一定条件下与浓HNO3反应生成的一硝基代物可能有3种 |
| D、1mol该有机物在一定条件下最多能与5mol H2发生加成反应 |
下列除杂或鉴别的方法不可行的是( )
| A、用Br2水可鉴别苯与乙醇 |
| B、将混合气体通过灼热的铜网除去N2中的少量O2 |
| C、用KMnO4溶液除去乙烯中的乙炔 |
| D、用适量HNO3除去NaNO3溶液中少量的Na2CO3 |




 (1)在25℃时,向100mL含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)H2,又经过4min,铁粉完全溶解.则:
(1)在25℃时,向100mL含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)H2,又经过4min,铁粉完全溶解.则: