��Ŀ����
��I�����з�Ӧ��210��ﵽƽ�⣺PCl5������
CO������+Cl2������
COCl2������
��1����Ӧ�ںͷ�Ӧ�۵�Kֵ����ʽ______�������ͬ����ͬ����
��2������Cl2Ũ�ȣ���Ӧ�۵�Kֵ______��������������١����䡱��
��3��Ҫʹ��Ӧ�ٺͷ�Ӧ�ڵ�Kֵ��ȣ�Ӧ��ȡ�Ĵ�ʩ��______
��a����Ӧ�١���Ӧ��ͬʱ�����¶�
��b����Ӧ�١���Ӧ��ͬʱ�����¶�
��c����Ӧ�ٽ����¶ȣ���Ӧ��ά��210��
����10�֣��ֽ�ˮ������CO����ֱ�ͨ�뵽���Ϊ1L�ĺ����ܱ������н��з�Ӧ��H2O��g��+CO��g��
 CO2��g��+H2��g������H���õ������������ݣ��ݴ˻ش��������⣺
CO2��g��+H2��g������H���õ������������ݣ��ݴ˻ش��������⣺| ʵ���� | �¶� | ��ʼ�� | ƽ���� | �ﵽƽ������ʱ�� | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650�� | 1mol | 2mol | 0.8mol | 0.8mol | 5min |
| 2 | 900�� | 0.5mol | 1mol | 0.2mol | 0.2mol | 3min |
| 3 | 900�� | a mol | b mol | c mol | d mol | t |
��2���Ƚϸ÷�Ӧʵ��1��ʵ��2��CO��ת���ʣ�a1______ a2���÷�Ӧ�ķ�Ӧ�ȡ�H______0�����������������=��������
��3����ʵ��3Ҫ�ﵽ��ʵ��2��Ч��ƽ��״̬����t��3min����a��bӦ����Ĺ�ϵ��______��ʵ��3����ʱ��Ӧ��ƽ�ⳣ��Ϊ______��
��4��900��ʱ����Ҫ���´ﵽƽ�⣬ʹc��CO2��/c��CO����ֵ��С����������������ʱ���ɲ�ȡ�Ĵ�ʩ�У�����ĸ��______��
A��ʹ�ø�Ч���� B������H2Ũ�� C�������¶� D����С���������
��2��ƽ�ⳣ��ֻ���¶��йأ������������أ�
��3�����ݷ�Ӧ�����Ȼ�����ص㣬�ı��¶�ʹƽ����ijһ�����ƶ����ɸı�ƽ�ⳣ���Ĵ�С��
����1�����û�ѧ��Ӧ���ʵļ��㹫ʽ���㣻
��2������ת����������������ʼ���Ĺ�ϵ���㲢�жϷ�Ӧ�ȣ�
��3���ӵ�Чƽ��ĽǶȷ�����
��4����ʹc��CO2��/c��CO����ֵ��С����ʹƽ�����淴Ӧ�����ƶ���
����⣺����1����Ӧ�ڢ�Ϊ�෴�ķ�Ӧ��K��Ϊ������ϵ�����߲�ͬ���ʴ�Ϊ����ͬ
��2��ƽ�ⳣ��ֻ���¶��йأ������������أ��ʴ�Ϊ������
��3��Ҫʹ��Ӧ�ٺͷ�Ӧ�ڵ�Kֵ��ȣ�
��a����Ӧ�١���Ӧ��ͬʱ�����¶ȣ���ٷ�Ӧƽ�����ƣ��ڷ�Ӧƽ�����ƣ�K������ȣ�����ȷ��
��b����Ӧ�١���Ӧ��ͬʱ�����¶ȣ���ٷ�Ӧƽ�����ƣ�K��С���ڷ�Ӧƽ�����ƣ�K�����߲�������ȣ��ʴ���
��c����Ӧ�ٽ����¶ȣ���ٷ�Ӧƽ�����ƣ�K��С����Ӧ��ά��210�棬���߲�������ȣ��ʴ���
�ʴ�Ϊ��a��
����1��v��CO2��=
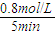 =0.16mol/��L?min�����ʴ�Ϊ��0.16��
=0.16mol/��L?min�����ʴ�Ϊ��0.16����2��ʵ��1��CO��ת����Ϊ
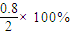 =40%��ʵ��2��CO��ת����Ϊ
=40%��ʵ��2��CO��ת����Ϊ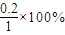 =20%����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ����÷�Ӧ���ȣ��ʴ�Ϊ����������
=20%����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ����÷�Ӧ���ȣ��ʴ�Ϊ������������3����ʵ��3Ҫ�ﵽ��ʵ��2��Ч��ƽ��״̬�������������ʵ����ʵ���֮�ȵ��ڳ�ʼԭ�ϵ����������b=2a����
t��3min��˵����Ӧ��������Ӧ��Ũ������������b��1��
ʵ��2��ʵ��3��Ӧ�¶���ȣ���Ӧ��ƽ�ⳣ����ȣ��ɸ���ʵ��2����ƽ�ⳣ����
H2O��g��+CO��g��
 CO2��g��+H2��g��
CO2��g��+H2��g����ʼ 0.5mol/L 1mol/L 0 0
ת�� 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
ƽ�� 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=
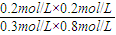 =0.167
=0.167 �ʴ�Ϊ��b=2a��l ����a��0.5��b=2a����b��1��b=2a����0.167��
��4����ʹc��CO2��/c��CO����ֵ��С����ʹƽ�����淴Ӧ�����ƶ�����ȡ�Ĵ�ʩ�����������¶Ȼ������������Ũ�ȵȴ�ʩ���ʴ�Ϊ��B��C��
���������⿼�黯ѧƽ��ͻ�ѧ��Ӧ���ʵ�֪ʶ������ʱע�����Ӱ��ƽ���ƶ��������Լ�ƽ�ⳣ�����йؼ��㣬��Ϊ��ѧƽ�ⳣ�������⣮

 �״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ����Ʊ��״���
�״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ����Ʊ��״���
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
��CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
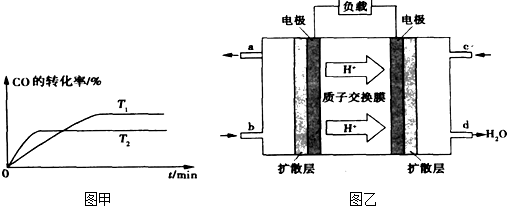
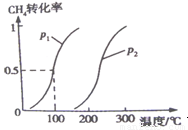
��0.20 mol CH4��0.30 mol H2O(g)ͨ���ݻ�Ϊ10 L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
���¶Ȳ��䣬��С������ٵ��淴Ӧ���� (���������С�����䡱)��
�Ʒ�Ӧ�ٵ�DH1 0(�������=������)100��Cʱ��ƽ�ⳣ��ֵK= ��
����ѹǿΪ0.1Mpa�����£���amolCO��3amolH2�Ļ�������ڴ��������½��з�Ӧ�������ɼ״���Ϊ�˷�Ѱ�Һϳɼ״������˵��¶Ⱥ�ѹǿ��ijͬѧ����˶���ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С����ڿո�������ʣ���ʵ���������ݡ�
| ʵ���� | T(��C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300��Cʱ�������������䣬���������ݻ�ѹ����ԭ����1/2����ƽ����ϵ������Ӱ����(����ĸ)�� ��
A��c(H2)���� B������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C��CH3OH�����ʵ������� D������ƽ��ʱc(H2)/c(CH2OH)��С
����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)=2CO2(g)��4H2O(g)DH=-1275.6 kJ��mol��1
��2CO(g)��O2(g)=2CO2(g) DH=-556.0 kJ��mol��1
 ��H2O(g)=H2O(l)DH=-44.0 kJ��mol��1
��H2O(g)=H2O(l)DH=-44.0 kJ��mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ ��
��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�
�ٸõ�������ĵ缫��ӦΪ ��
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��
��14�֣��״�����Ϊ21���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ�ٺ͢ڣ���CH4��H2OΪԭ�����Ʊ��״�����CH4��g����H2O ��g�� CO��g����3H2��g�� ��H1 ��CO��g����2H2��g��
CH3OH��g�� ��H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
��1���¶Ȳ��䣬��С���������ѹǿ���ٵķ�Ӧ���� �����������С���������䡱����ƽ���� �����ƶ���
��2����Ӧ�ٵġ�H1 0���������������������������ƽ�ⳣ������ʽΪK= ��100�棬ѹǿΪp1ʱƽ�ⳣ����ֵ�� ��
��3����ѹǿΪ0��1Mpa�����£���a mol CO��3a molH2�Ļ�������ڴ��������½��з�Ӧ�ڡ�Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С������¿ո�������ʣ���ʵ���������ݡ�
| ʵ���� | T�� | n��CO��/n��H2�� | p ��Mpa�� |
| I | 150 | 1/3 | 0��1 |
| �� |
|
| 5 |
| �� | 350 |
| 5 |
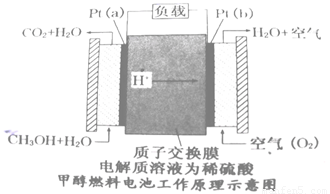
��4�������꿪���ļ״�ȼ�ϵ���Dz��ò��缫������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ��ʾ��ͼ���£�
��ش�
��Pt��a���缫�ĵ缫��ӦʽΪ
������õ�ع���ʱ��·��ͨ��2mol���������ĵ�CH3OH�� mol��
��14�֣��״�����Ϊ21���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ�ٺ͢ڣ���CH4��H2OΪԭ�����Ʊ��״�����CH4��g����H2O ��g��  CO��g����3H2��g�� ��H1 ��CO��g����2H2��g��
CO��g����3H2��g�� ��H1 ��CO��g����2H2��g��
 CH3OH��g�� ��H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH��g�� ��H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
��1���¶Ȳ��䣬��С���������ѹǿ���ٵķ�Ӧ���� �����������С���������䡱����ƽ���� �����ƶ���
��2����Ӧ�ٵġ�H1 0���������������������������ƽ�ⳣ������ʽΪK= ��100�棬ѹǿΪp1ʱƽ�ⳣ����ֵ�� ��
��3����ѹǿΪ0��1Mpa�����£���a mol CO��3a molH2�Ļ�������ڴ��������½��з�Ӧ�ڡ�Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С������¿ո�������ʣ���ʵ���������ݡ�
|
ʵ���� |
T�� |
n��CO��/n��H2�� |
p ��Mpa�� |
|
I |
150 |
1/3 |
0��1 |
|
�� |
|
|
5 |
|
�� |
350 |
|
5 |
��4�������꿪���ļ״�ȼ�ϵ���Dz��ò��缫������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ��ʾ��ͼ���£�
��ش�
��Pt��a���缫�ĵ缫��ӦʽΪ
������õ�ع���ʱ��·��ͨ��2mol���������ĵ�CH3OH�� mol��