题目内容
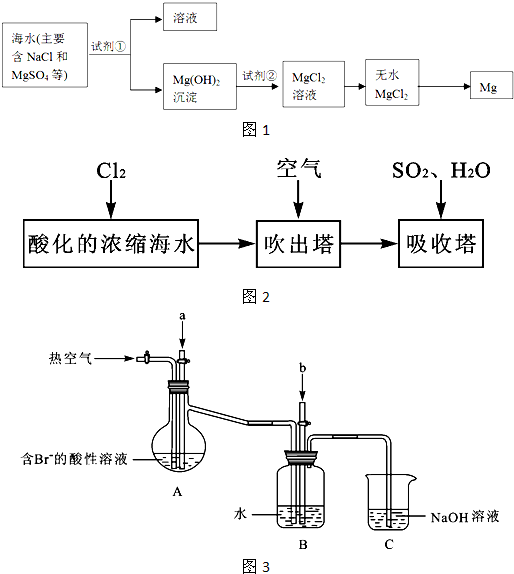
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.主要步骤如图: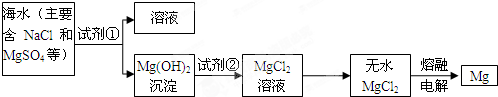
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
(3)试剂②选用
分析:向海水中加入沉淀剂,镁离子转化为Mg(OH)2,采用过滤的方法分离溶液和Mg(OH)2,Mg(OH)2将溶于稀盐酸得到MgCl2溶液,将MgCl2溶液在HCl氛围中蒸干得到MgCl2固体,电解熔融MgCl2固体得Mg.
(1)根据阴离子变化确定沉淀剂,要使镁离子完全转化为沉淀,则加入的沉淀剂要过量;
(2)分离不溶性固体和溶液采用过滤的方法;
(3)根据阴离子变化确定试剂②且不能引进杂质.
(1)根据阴离子变化确定沉淀剂,要使镁离子完全转化为沉淀,则加入的沉淀剂要过量;
(2)分离不溶性固体和溶液采用过滤的方法;
(3)根据阴离子变化确定试剂②且不能引进杂质.
解答:解:向海水中加入沉淀剂,镁离子转化为Mg(OH)2,采用过滤的方法分离溶液和Mg(OH)2,Mg(OH)2将溶于稀盐酸得到MgCl2溶液,将MgCl2溶液在HCl氛围中蒸干得到MgCl2固体,电解熔融MgCl2固体得Mg.
(1)使MgSO4完全转化为Mg(OH)2,应选择碱且碱要过量,在转化中不引入新的离子,则试剂①选择NaOH,故答案为:NaOH;过量;
(2)分离不溶性固体和溶液采用过滤的方法,所以该操作是过滤,故答案为:过滤;
(3)Mg(OH)2转化为MgCl2时,酸能溶解沉淀,由阴离子可知,试剂②可以选用盐酸,离子方程式为:Mg(OH)2+2H+=Mg 2++2H2O,
故答案为:盐酸;Mg(OH)2+2H+=Mg 2++2H2O.
(1)使MgSO4完全转化为Mg(OH)2,应选择碱且碱要过量,在转化中不引入新的离子,则试剂①选择NaOH,故答案为:NaOH;过量;
(2)分离不溶性固体和溶液采用过滤的方法,所以该操作是过滤,故答案为:过滤;
(3)Mg(OH)2转化为MgCl2时,酸能溶解沉淀,由阴离子可知,试剂②可以选用盐酸,离子方程式为:Mg(OH)2+2H+=Mg 2++2H2O,
故答案为:盐酸;Mg(OH)2+2H+=Mg 2++2H2O.
点评:本题考查了海水中镁的提取,从整体上把握提取镁的流程,知道提取过程中发生的反应及操作方法,知道试剂的选取方法,知道镁采用电解熔融氯化镁的方法冶炼,题目难度不大.

练习册系列答案
相关题目