题目内容
1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图所示),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30.
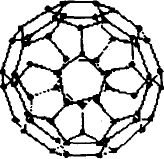
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是________,理由是________.
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”):________,并简述其理由:________.
(3)通过计算确定C60分子所含单键数,C60分子所含单键数为________.
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目.
C70分子中所含五边形数为________,六边形数为________.
解析:
|
(1)金刚石属于原子晶体,而固体C60不是,故金刚石熔点较高. (2)可能,因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60. (3)依题意,C60分子形成的化学键数为:(3×60)/2=90 也可由欧拉定理计算键数(即棱边数):60+(12+20)-2=90 C60分子中单键为:90-30=60 (4)设C70分子中五边形数为x,六边形数为y.依题意可得方程组: (5x+6y)/2=(3×70)/2(键数,即棱边数)① 70+(x+y)-(3×70)/2=2(欧拉定理)② 解得:五边形数x=12,六边形数y=25 |
提示:
|
根据晶体中共享的原则判断成键的数量:每个碳原子形成3个键,但是每个键被两个碳原子共用,即每个成键原子占有1/2;单双键数量除了根据欧拉定理计算,也可由成键电子数计算得到:设单键数为x,双键数为y,则x+y=90,2x+4y=60×4(成键电子总数). |

| A、C60与棒碳中所有的化学键都是非极性共价键 | B、棒碳不能使溴水褪色 | C、C60在一定条件下可能与CuO发生置换反应 | D、棒碳与乙炔互为同系物 |



 法正确的是 ( )
法正确的是 ( )