题目内容
11.(1)写出下列冶炼金属的化学反应方程式:①用红锌矿(ZnO)冶炼锌CO+ZnO$\frac{\underline{\;\;△\;\;}}{\;}$Zn+CO2;
②用磁铁矿(Fe3O4)冶炼铁4CO+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2;
③用食盐(NaCl)冶炼钠2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
(2)高温灼烧孔雀石[Cu2(OH)2CO3]和木炭的混合物可得到一种紫红色光泽的金属,其反应的化学方程式为Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑,C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
(3)用纯净的铝土矿(Al2O3)、冰晶石和二氧化锰作原料可制取金属锰(冰晶石作Al2O3的溶剂),其化学反应方程式为2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$2Al+3O2↑;4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3.
(4)请简述几种常见的防止金属腐蚀的方法发蓝、覆盖保护层、电化学保护法 (不低于三种).
分析 (1)金属的冶炼一般有电解法、热还原法、热分解法.
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得;
(2)高温灼烧孔雀石[Cu2(OH)2CO3]和木炭的混合物,可得到一种紫红色光泽的金属为铜,Cu2(OH)2CO3为受热分解生成氧化铜、水、二氧化碳,氧化铜与碳反应生成铜和二氧化碳;
(3)铝为活泼金属用电解氧化铝制备铝,可以用铝热反应来冶炼金属锰;
(4)金属的腐蚀分为化学腐蚀和电化学腐蚀,影响金属腐蚀的因素分为金属的本性和介质两个方面;通常采用的防止发生腐蚀方法有:改变金属内部组织结构、在金属表面覆盖保护层和电化学保护法,据此进行解答.
解答 解:(1)由Fe、Zn、Cu等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原.
①用红锌矿(ZnO)冶炼锌,用热还原法,该反应的化学反应方程式为:CO+ZnO$\frac{\underline{\;\;△\;\;}}{\;}$Zn+CO2,
故答案为:CO+ZnO$\frac{\underline{\;\;△\;\;}}{\;}$Zn+CO2;
②用磁铁矿(Fe3O4)冶炼铁,铁用热还原法,该反应的化学反应方程式为:4CO+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2,
故答案为:4CO+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2;
③Na是活泼金属,工业上采用电解熔融NaCl的方法冶炼,该反应的化学反应方程式为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,
故答案为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
(2)高温灼烧孔雀石[Cu2(OH)2CO3]和木炭的混合物,Cu2(OH)2CO3受热分解生成氧化铜、水、二氧化碳,反应的化学方程式为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑,在高温条件下,碳能与氧化铜反应,生成了铜和二氧化碳,反应的方程式是:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,
故答为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑,C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
(3)用纯净的铝土矿(Al2O3)、冰晶石和二氧化锰作原料可制取金属锰:高温下电解氧化铝的熔融物可以得到金属铝2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$2Al+3O2↑,利用铝热反应:金属铝和二氧化锰之间的反应来冶炼金属锰,即2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$2Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$2Al+3O2↑;4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
(4)金属的腐蚀与金属自身的化学性质有关,一般来讲,化学性质比较活泼的金属容易被腐蚀,另外金属的腐蚀还与金属所处的环境因素有关,影响金属腐蚀的因素包括金属的本性和介质两个方面;所以防止金属腐蚀的方法有很多种,如:改变金属内部组织结构,如合金、发蓝,在金属表面覆盖保护层,如:在铁制品表面涂矿物性油、油漆或烧制搪瓷、喷塑等,还可以利用电化学保护法,如将金属与外加电源的负极相连等,
故答案为:发蓝、覆盖保护层、电化学保护法.
点评 本题考查金属的冶炼,掌握电解法、热还原法、热分解法的适用对象,注意知识的归纳和梳理是关键,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 1:1:1 | B. | 1:1:2 | C. | 1:2:3 | D. | 2:2:3 |
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
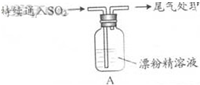 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰.
②由实验a、b不能判断白雾中含有HC1,理由是白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色
(5)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4.
②用离子方程式解释现象iii中黄绿色褪去的原因:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
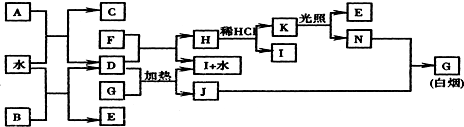
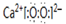 ;K的结构式是H-O-Cl.
;K的结构式是H-O-Cl.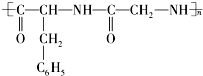 的单体是( )
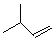
的单体是( )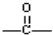
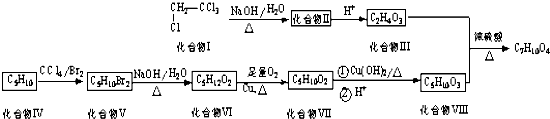
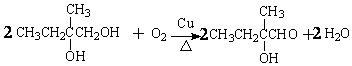 .
. ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为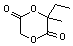 .
. 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.