题目内容
5.写出下列反应的离子方程式:(1)铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
(2)向氯化铁溶液加入铁粉:Fe+2Fe3+=3Fe2+
(3)向澄清石灰水中通入过量二氧化碳气体:CO2+OH-=HCO3-.
分析 (1)反应生成硝酸铜、NO和水;
(2)反应生成氯化亚铁;
(3)反应生成碳酸氢钙.
解答 解:(1)铜与稀硝酸反应的离子反应为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(2)向氯化铁溶液加入铁粉的离子反应为Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(3)向澄清石灰水中通入过量二氧化碳气体的离子反应为CO2+OH-=HCO3-,故答案为:CO2+OH-=HCO3-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
18.下列化学用语中,不正确的是( )
| A. | CO2的电子式: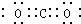 | B. | 乙炔分子的结构式H-C≡C-H | ||
| C. | H2O分子的比例模型  | D. | Clˉ离子的结构示意图: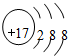 |
19.某稀溶液中含有HCO3-、SO32-、CO32-、CH3COO-、NH4+、Na+等多种阴、阳离子.若向其中加入适量的Na2O2固体后,你认为原溶液中离子浓度基本保持不变的微粒有( )
| A. | 3种 | B. | 2种 | C. | 1种 | D. | 无,都有变化 |
13.胶体在人们的日常生活中随处可见.下列分散系属于胶体的是( )
| A. | 泥水 | B. | 豆浆 | C. | 生理盐水 | D. | 油水双合物 |
10.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热NaCl使之融化 | D. | 氢气在氯气中燃烧 |
17.下列说法中,正确的是( )
| A. | 在光照条件下,体积比为1:1的CH4和Cl2充分反应可以制取CH3Cl | |
| B. | 乙烯和苯都可与溴水发生加成反应 | |
| C. | 用新制氢氧化铜可以检验淀粉是否完全水解 | |
| D. | 分子式同为C3H7Cl,但沸点不同的分子共有两种 |
14.在短周期元素中,甲元素与乙、丙、丁三种元素紧密相邻(上下左右均可能),四种元素的最外层电子数之和为24,甲、乙两元素的原子序数之和比丙元素的原子序数多1.下列说法中正确的是( )
| A. | 四种元素中,丁元素的原子半径最小 | |
| B. | 气态氢化物的稳定性:乙>丙 | |
| C. | 同浓度的最高价含氧酸溶液的H+浓度丁>丙 | |
| D. | 元素甲和丙形成的两种常见化合物均为强还原剂 |
15.a、b、c、d为原子序数依次增大的短周期主族元素,a的最外层电子数为其质子数的一半,b的最外层只有1个电子,c的最高化合价与最低化合价的代数和为4.下列叙述正确的是( )
| A. | a是一种非金属元素 | |
| B. | b与氧元素组成的氧化物一定是碱性氧化物 | |
| C. | c和d形成的化合物c2d2中各原子的最外层均达到8电子稳定结构 | |
| D. | b、c、d与氢元素形成的化合物中化学键均为极性共价键 |