题目内容
10.以空气、海水和贝壳为原料可进行多种化工生产,如图1是课本介绍的几种基本工业生产,根据各物质的转化关系回答下列问题:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:a.盐酸 b.氯化钡溶液 c.氢氧化钠溶液 d.碳酸钠溶液.则加入试剂的顺序是(填编号)bdca 或cbda或bcda.
(2)工业上从空气中分离出A是利用空气中沸点各成分的不同;
(3)C、D反应可制取一种常用的消毒剂,写出反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;写出生成G+H的化学方程式:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;
(4)合成E时要使产率增大、反应速率加快,可采取的办法是②⑥
①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合气中分离出E ⑥补充A或B ⑦加催化剂 ⑧减小A或B的量
(5)电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是d;
a.精制饱和食盐水进入阳极室 b.纯水(加少量NaOH)进入阴极室
c.阴极产物为氢氧化钠和氢气 d.阳极的电极反应为:Cl2+2e-═2Cl-
(6)母液中常含有MgCl2、NaCl、MgSO4、KCl等(其溶解度与温度的关系如图2所示),可进一步加工制得一些重要的产品.若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是NaCl和MgSO4;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的KCl晶体.
分析 贝壳的主要成分为CaCO3,加热可生成CaO和CO2,由纯碱可知H为NaHCO3,则F和E的反应应为侯氏制碱法的反应,由此可知F为CO2,E为NH3,G为NH4Cl,A为分离空气得到的物质,所以A为N2,所以B为H2,电解食盐水得氯气、氢氧化钠和氢气,所以C、D为Cl2和NaOH,
(1)根据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)根据氮气和氧气的沸点不同可以分离子空气得到氮气和氧气;
(3)氯气和氢氧化钠反应生成次氯酸钠和氯化钠,水、二氧化碳、氨气、氯化钠反应生成氯化铵和碳酸氢钠;
(4)合成氨的反应是气体体积减小的放热反应,根据影响反应速率和平衡移动的因素答题;
(5)电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(6)加热时析出晶体,说明该晶体溶解度随温度的升高而降低;降温时析出晶体,说明该晶体溶解度随温度的降低而降低以,用一定量的冷水洗涤该晶体,比较温度较低时两种物质的溶解度大小,溶解度小的物质就会析出.
解答 解:贝壳的主要成分为CaCO3,加热可生成CaO和CO2,由纯碱可知H为NaHCO3,则F和E的反应应为侯氏制碱法的反应,由此可知F为CO2,E为NH3,G为NH4Cl,A为分离空气得到的物质,所以A为N2,所以B为H2,电解食盐水得氯气、氢氧化钠和氢气,所以C、D为Cl2和NaOH,
(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为BDCA 或 CBDA 或BCDA等,
故答案为:bdca 或cbda 或bcda;
(2)根据氮气和氧气的沸点不同可以分离子空气得到氮气和氧气,
故答案为:沸点;
(3)氯气和氢氧化钠反应生成次氯酸钠和氯化钠,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,水、二氧化碳、氨气、氯化钠反应生成氯化铵和碳酸氢钠,反应的方程式为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;
(4)合成氨的反应是气体体积减小的放热反应,所以要使产率增大、反应速率加快可以加压、补充氮气或氢气,故选②⑥;
(5)a、阳极是氯离子失电子发生氧化反应,精制饱和食盐水进入阳极室,故a正确;
b、阴极是氢离子得到电子生成氢气,纯水(加少量NaOH)进入阴极室,故b正确;
c、阴极是氢离子得到电子生成氢气发生还原反应,阴极附近水电离平衡破坏,氢氧根离子浓度增大结合钠离子生成氢氧化钠,故c正确;
d、阳极的电极反应为:2Cl--2e-═Cl2↑,故d错误;
故选d;
(6)观察溶解度图象,当温度大于60℃,随着温度的升高,MgSO4的溶解度反而下降,NaCl的溶解度一直比较低.所以这两种物质就会结晶析出;
降温时析出晶体,说明该晶体溶解度随温度的降低而降低,从图象可以看出,MgCl2和KCl随着温度的降低而下降,将母液R降温(降到30℃以下)析出晶体主要是MgCl2,KCl,从图象可以看出,在温度较低时,MgCl2的溶解度大于KCl的溶解度,所以冷水洗涤时较纯的KCl固体就会析出;
故答案为:NaCl和MgSO4;KCl.
点评 本题考查了电解池的工作原理知识,粗盐提纯的实验方案设计步骤及注意事项以及化学方程式的书写,化学来源于生产、生活,又服务于生产、生活,学习中注意积累化学知识,才能综合应用,题目难度中等.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | NH4+ | B. | Mg2+ | C. | Cu2+ | D. | Fe3+ |
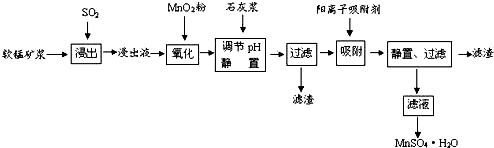
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中一定有乙炔 |
| A. | 原子半径大小:Na>S>O | B. | 酸性强弱:HClO4>HBrO4>HIO4 | ||
| C. | 碱性强弱:Ba(OH)2>Sr(OH)2>Ca(OH)2 | D. | 非金属性强弱:Cl>Se>Br |

