题目内容
【题目】Fe(OH)2在空气中容易变质。某同学欲利用如图所示装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。请回答下列问题:
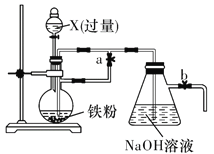
(1)X可以是________(填字母代号)。
A.稀硫酸 B.浓硫酸
C.稀硝酸 D.稀盐酸
(2)实验开始时,向烧瓶中加入X前,应________(填字母代号)。
A.先关闭止水夹a、b B.先打开止水夹a、b
C.先关闭止水夹b、打开a D.先关闭止水夹a、打开b.
(3)烧瓶中发生反应的离子方程式为___________________________________________。
(4)反应一会后,在b导管口收集检验氢气纯净后,关闭______(填“a”或“b”),一段时间后,可在烧瓶中观察到的现象是_________________________________________________________。
(5)反应结束后,为确保Fe(OH)2可较长时间存在,则应关闭分液漏斗活塞和止水夹________(填“a”或“b”)。
【答案】AD B ![]() a 铁粉溶解,溶液沿导管流向锥形瓶 b
a 铁粉溶解,溶液沿导管流向锥形瓶 b
【解析】
Fe(OH)2在空气中容易被氧化,因此要想较长时间看到Fe(OH)2沉淀,需要隔绝空气。分液漏斗中放入稀H2SO4或稀HCl,与蒸馏烧瓶中的Fe反应,生成Fe2+和H2。实验开始时先打开a、b,使H2进入后续装置,将装置中的空气赶走,反应一段时间,在b导管口收集检验氢气纯净后关闭a,蒸馏烧瓶中的Fe2+在压力的作用下通过导管进入NaOH中,生成Fe(OH)2,最后关闭b和分液漏斗活塞,防止空气进入装置,就能较长时间地看到Fe(OH)2沉淀。
(1)与Fe反应制H2,不能用氧化性酸,因此选AD;
(2)根据分析,开始前应先打开止水夹a、b,故选B;
(3)烧瓶中Fe与H+反应制H2,离子方程式为:![]() ;
;
(4)根据分析,在b导管口收集检验氢气纯净后关闭a,以便于将蒸馏烧瓶中的Fe2+压入NaOH中;烧瓶中的现象为Fe粉溶解,溶液沿导管流向锥形瓶;
(5)要想较长时间看到Fe(OH)2沉淀,需要隔绝空气,因此需要关闭分液漏斗活塞和止水夹b;

【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓氨水 | NaOH | 酚酞 | NaOH的碱性比 NH3H2O的强 | |
B | 浓盐酸 | MnO2 | 淀粉溶液 | 非金属性:氯元素大于碘元素 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)请写出下列元素的元素符号:①________③_________⑨___________。
(2)元素①④按2:1组成的化合物中化学键为_________。(填“共价键”或“离子键”)
(3)②的单质与⑧的最高价氧化物水化物热的浓溶液反应的化学方程式为____________。
(4)⑤⑥⑦的最高价氧化物水化物的碱性从大到小的顺序____________。(填化学式)
(5)④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为____________(填离子符号)。
(6)④和⑧的氢化物稳定性从大到小的顺序为______________________。(填化学式)
(7)元素④的氢化物与⑤发生反应的方程式_____________,所得溶液PH____7(填“>”或“<”或“=”)。