题目内容
某化学学习小组在某气体流中将钙加热到450℃制得红棕色固体M,取1.88g该固体置于下列装置中进行性质实验.
(1)实验开始后,产生使B中红色石蕊试纸变蓝的气体X,则该气体X的化学式为 ;同时E中黑色粉末逐渐变为红色并收集到气体N,则E中发生反应的化学反应方程式为 .
(2)待充分反应并冷却,称量E装置的总质量,与反应前相比质量减少0.64g,且收集到气体N的体积为0.224L(标况下),则E中实际参与反应的CuO和X的物质的量之比为 ;与反应的理论比值相比造成这一结果可能的原因是 ;
(3)根据计算,写出该红棕色固体的电子式 .
(1)实验开始后,产生使B中红色石蕊试纸变蓝的气体X,则该气体X的化学式为
(2)待充分反应并冷却,称量E装置的总质量,与反应前相比质量减少0.64g,且收集到气体N的体积为0.224L(标况下),则E中实际参与反应的CuO和X的物质的量之比为
(3)根据计算,写出该红棕色固体的电子式

考点:无机物的推断
专题:推断题
分析:产生使B中红色石蕊试纸变蓝的气体X,X应为NH3,M应为Ca3N2,NH3和CuO在加热条件下反应生成Cu和N2,待充分反应并冷却,称量E装置的总质量,与反应前相比质量减少0.64g,应为O的质量,可知n(CuO)=n(O)=
=0.04mol,且收集到气体N的体积为0.224L(标况下),N为N2,结合反应的方程式计算.
| 0.64g |
| 16g/mol |
解答:
解:(1)实验开始后,产生使B中红色石蕊试纸变蓝的气体X,X应为NH3,NH3和CuO在加热条件下反应生成Cu和N2,反应的方程式为2NH3+3CuO
3Cu+N2+3H2O,
故答案为:NH3;2NH3+3CuO
3Cu+N2+3H2O;
(2)待充分反应并冷却,称量E装置的总质量,与反应前相比质量减少0.64g,应为O的质量,可知n(CuO)=n(O)=
=0.04mol,且收集到气体N的体积为0.224L(标况下),N为N2,物质的量为0.01mol,则n(NH3)=0.02mol,由方程式可知二者的物质的量应为3:2,而实际为2:1,说明参加反应的CuO较多,可知生成的Ca3N2中含有Ca,与水反应生成氢气,导致CuO和NH3的物质的量之比偏大,
故答案为:2:1;原Ca3N2中含有Ca,与水反应生成氢气,导致CuO和NH3的物质的量之比偏大;
(3)该红棕色固体的电子式为 ,故答案为:
,故答案为: .
.
| ||
故答案为:NH3;2NH3+3CuO
| ||
(2)待充分反应并冷却,称量E装置的总质量,与反应前相比质量减少0.64g,应为O的质量,可知n(CuO)=n(O)=
| 0.64g |
| 16g/mol |
故答案为:2:1;原Ca3N2中含有Ca,与水反应生成氢气,导致CuO和NH3的物质的量之比偏大;
(3)该红棕色固体的电子式为
 ,故答案为:
,故答案为: .
.
点评:本题考查无机物的推断,侧重于分析能力和实验能力的考查,注意把握实验的原理以及实验的基本操作,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、室温下,1L pH=1的盐酸中,由水电离的H+离子数目为0.1NA |
| B、标况下,11.2L SO3所含的分子数目为0.5NA |
| C、甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA |
| D、1 mol C2H6O分子中含有的O-H键数目一定为NA |
煤中含有的硫在燃烧时以二氧化硫的形式排放到大气中,会导致酸雨.工业上常在煤中加入一些物质或将燃烧尾气进行集中处理以控制和消除其对大气的影响.下列物质中,不能用于控制和消除二氧化硫对大气影响的是( )
| A、氨水 | B、石英 |
| C、石灰石 | D、熟石灰 |
法国里昂的科学家最近发现一种由四个中子组成的微粒,这种微粒被称为“四中子”,也有人称之为“零号元素”,它与天体中的中子星构成类似.下列有关“四中子”微粒的说法正确的是( )
| A、该微粒是一种原子 |
| B、该微粒不显电性 |
| C、该微粒与普通中子互为同位素 |
| D、该微粒的质量数为2 |

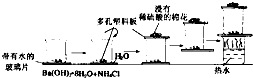 某同学设计如图的实验方案来探究NH4Cl和Ba(OH)2?8H2O反应中的能量变化.根据他的实验步骤填写对应的实验现象和结论.
某同学设计如图的实验方案来探究NH4Cl和Ba(OH)2?8H2O反应中的能量变化.根据他的实验步骤填写对应的实验现象和结论.