题目内容
12.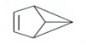 盆烯是近年来运用立体空间化学制造出来的空间单烯烃,因其分子形似瓦盆,故称为盆烯,其结构简式如图所示.下列关于盆烯的说法中正确的是( )
盆烯是近年来运用立体空间化学制造出来的空间单烯烃,因其分子形似瓦盆,故称为盆烯,其结构简式如图所示.下列关于盆烯的说法中正确的是( )| A. | 分子式为C6H8 | |
| B. | 是乙烯的一种同系物 | |
| C. | 在一定条件下可以发生加成、氧化反应 | |
| D. | 1 mol盆烯完全燃烧需消耗6.5molO2 |
分析 由结构可知分子式,分子中含碳碳双键,结合烯烃的性质来解答.
解答 解:A.由结构可知分子式为C6H6,故A错误;
B.与乙烯结构不相似,该有机物存在环状结构,不是乙烯同系物,故B错误;
C.含碳碳双键,可发生加成、氧化反应,故C正确;
D.1 mol盆烯完全燃烧需消耗1mol×(6+$\frac{6}{4}$)=7.5molO2,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握结构、官能团、性质及有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃的性质及应用,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
2.下列实验操作或说法正确的是( )
| A. | 取4g NaOH加入100mL水中配制浓度为1.0mol/L的NaOH溶液 | |
| B. | 配制一定浓度的溶液时,用蒸馏水润洗容量瓶会使所配制出的溶液浓度偏低 | |
| C. | 除去Fe(OH)3胶体中混有的Cl-离子,可用过滤的方法 | |
| D. | 向盛有铜片的试管中加入浓硫酸,加热证明浓硫酸具有强氧化性 |
3.a g H2SO4中含有b个氢原子,则阿伏加德罗常数为( )
| A. | $\frac{49a}{b}$ mol-1 | B. | $\frac{49b}{a}$ mol-1 | C. | $\frac{98a}{b}$ mol-1 | D. | $\frac{98b}{a}$ mol-1 |
20.下列物质能和水发生化合反应的是( )
| A. | Al2O3 | B. | Na2O2 | C. | MgO | D. | NO2 |
7.反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )
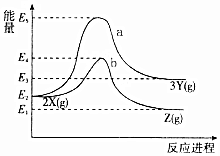

| A. | X→Y反应的活化能为E5 | |
| B. | 加入催化剂曲线a变为曲线b | |
| C. | 升高温度增大吸热反应的活化能,从而使化学反应速率加快 | |
| D. | 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快 |
8.氨和铵盐既是实验室常用试剂又是重要化工原料.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.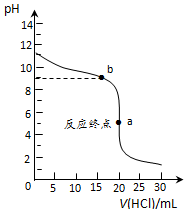
①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O
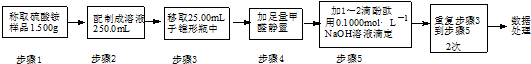
滴定结果如表所示:
试计算该样品中氮元素的质量分数(写出计算过程)计算平均消耗溶液体积V=$\frac{20.01ml+19.99ml+20.00ml}{3}$=20.00ml,
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.

①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O

滴定结果如表所示:
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
