题目内容
下列粒子不具有氧化性的是
| A.ClO- | B.MnO4- | C.SO32- | D.S2- |
D
解析试题分析:氧化性在反应中得到电子,化合价降低,据此可以判断。A、ClO-中氯元素的化合价是+1价,可以得到电子,表现出氧化性,A不符合题意;B、MnO4-中Mn的化合价是+7价,可以得到电子,表现出氧化性,B不符合题意;C、SO32-中S元素的化合价是+4价,可以得到电子,表现出氧化性,C不符合题意;D、S2-中S元素的化合价是-2价,在反应中只能失去电子,表现出还原性,不能表现出氧化性,D正确,答案选D。
考点:考查氧化性判断

PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是( )
| A.2:1混合的Pb3O4、PbO |
| B.1:2混合的PbO2、Pb3O4 |
| C.1:4:1混合的PbO2、Pb3O4、PbO |
| D.1:1:4混合的PbO2、Pb3O4、PbO |
下列反应类型的判断,不正确的是( )
A.CO2+H2O H2CO3化合反应 H2CO3化合反应 |
B.Cu(OH)2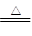 CuO+H2O 分解反应 CuO+H2O 分解反应 |
C.MnO2+2CO Mn+2CO2置换反应 Mn+2CO2置换反应 |
| D.NaCl+AgNO3=AgCl↓+NaNO3复分解反应 |
已知2Fe+3Br2 →2FeBr3 、2 Fe3++2I-→ 2 Fe2++I2, 现将Fe(NO3)2溶液分别滴入到以下溶液中①H2SO4②HNO3③溴水 ④碘水,其中能使Fe2+转变为Fe3+的是 ( )
| A.①②③④ | B.只有②③ | C.①②③ | D.②③④ |
在8NH3+3Cl2=N2+6NH4Cl反应中,在该反应中氧化剂和还原剂的分子个数之比是( )。
| A.3:1 | B.3:8 | C.3:2 | D.8:3 |
在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为
SiC+2CO↑反应中,氧化剂和还原剂的质量比为
| A.36:30 | B.60:36 | C.2:1 | D.1:2 |
发射“嫦娥二号”的长征火箭由三个子级构成。其中一子级上部装有液体四氧化二氮(N2O4),下部装有液体偏二甲肼(C2H8N2)高能燃料。发动机内燃烧的化学方程式为:C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑,该反应中
| A.C2H8N2发生还原反应 | B.C2H8N2是氧化剂 |
| C.N2O4发生氧化反应 | D.N2O4是氧化剂 |
为使Fe2+,Fe3+,Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH7.7、 pH4.5、pH6.6。某硫酸锌酸性溶液中含有少量Fe2+,Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是
| A.H2O2,ZnO | B.氨水 | C.KMnO4,ZnCO3 | D.NaOH溶液 |