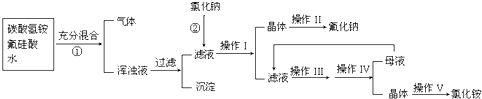
题目内容
 下列为实验室制取、干燥和收集氨气的装置.
下列为实验室制取、干燥和收集氨气的装置.(1)装置A中向烧瓶中添加液态试剂的仪器的名称是
分液漏斗
分液漏斗
;仪器的连接顺序为a→b→c→e→d
b→c→e→d
.若液态试剂是浓氨水,则烧瓶中所加的一种固体试剂可以是氧化钙或固体氢氧化钠或碱石灰
氧化钙或固体氢氧化钠或碱石灰
.(2)某同学称取2g氯化铵固体置于烧瓶中,再快速称取2g氢氧化钠覆盖在氯化铵上方,组装好装置后,向烧瓶内滴加水,也能得到氨气.下面为该方法制取氨气的原因分析,其中合理的是
①②③④
①②③④
(填序号).①在氨水中存在平衡NH3+H2O?NH3?H2O?NH
+ 4 |
②在氨水中存在平衡NH3+H2O?NH3?H2O?NH
+ 4 |
③NaOH固体溶于水时放热,使体系的温度升高,NH3的溶解度减小,会有部分NH3逸出
④NH4Cl与NaOH在此情况下可反应生成NH3,即NH
+ 4 |
| ||
分析:(1)依据装置分析制备氨气气体是利用液体通过分液漏斗滴入烧瓶中不加热进行的反应,实验目的是制取、干燥和收集氨气的装置,制备氨气先干燥再收集,氨气比空气轻,应用向下排气法收集;制备氨气可以利用浓氨水滴入氧化钙或固体氢氧化钠或碱石灰,溶解放热时一水合氨分解生成氨气;
(2)依据氨气和水反应生成一水合氨,一水合氨存在电离平衡,改变条件平衡发生移动.
(2)依据氨气和水反应生成一水合氨,一水合氨存在电离平衡,改变条件平衡发生移动.
解答:解:(1)装置是在烧瓶中加入固体,从分液漏斗中滴加液体,不需要加热制备气体的反应发生装置,实验目的是制取、干燥和收集氨气的装置,制备氨气后先干燥再收集,氨气比空气轻,应用向下排气法收集;氨气是碱性气体可以用碱性干燥剂干燥,制备氨气依据装置特征可以选用浓氨水滴入固体氧化钙或氢氧化钠或碱石灰中,利用固体溶解放热使一水合氨发生分解生成,
故答案为:分液漏斗;b→c→e→d;氧化钙或固体氢氧化钠或碱石灰;
(2)称取2g氯化铵固体置于烧瓶中,再快速称取2g氢氧化钠覆盖在氯化铵上方,组装好装置后,向烧瓶内滴加水,也能得到氨气,反应过程分析是,生成的一水合氨是弱电解质,在氨水中存在平衡NH3+H2O?NH3?H2O?NH
+OH-,加入氢氧化钠,氢氧根离子浓度增大,平衡左移有利于氨气放出,故①正确;加入氯化铵铵根离子浓度增大,平衡左移,利于氨气放出,故②正确;固体氢氧化钠溶解过程中放热,促使一水合氨分解生成氨气,故③正确;氯化铵和氢氧化钠混合反应放热生成氨气,NH
+OH-
NH3↑+H2O,故④正确;
故答案为:①②③④.
故答案为:分液漏斗;b→c→e→d;氧化钙或固体氢氧化钠或碱石灰;
(2)称取2g氯化铵固体置于烧瓶中,再快速称取2g氢氧化钠覆盖在氯化铵上方,组装好装置后,向烧瓶内滴加水,也能得到氨气,反应过程分析是,生成的一水合氨是弱电解质,在氨水中存在平衡NH3+H2O?NH3?H2O?NH
+ 4 |
+ 4 |
| ||
故答案为:①②③④.
点评:本题考查了实验制备气体的装置分析和试剂选择,实验探究和分析,物质性质的熟练掌握是解题关键,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程: