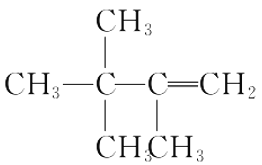
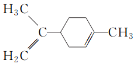
题目内容
【题目】己知A、B、C、D、E五种元素的核电荷数依次增大,A原子中p轨道电子数是s轨道电子数的一半;C、D同主族,且D的原子序数是C的2倍;E是第四周期ds区不活泼金属元素。根据以上信息用相应的元素符号填空:
(1)E+核外电子排布式为_______________,DC42-离子的空间构型为_____________________。
(2)ABC三元素第一电离能大小顺序为________________。
(3)D元素在周期表中的位置_______________,能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是__________________(填化学式)。
(4)已知EDC4溶液中滴入氨基乙酸钠![]() 即可得到配合物G。其结构如图所示:
即可得到配合物G。其结构如图所示:
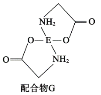
配合物G中碳原子的轨道杂化类型为_________________________________。
(5)(AB)2的电子式为____________________________。
【答案】1s22s22p63s23p63d10 正四面体 N>O>C 第3周期ⅥA族 C>Cu>S>N2 sp3、sp2 ![]()
【解析】
A、B、C、D、E五种元素的核电荷数依次增大,A原子中p轨道电子数是s轨道电子数的一半,其原子核外电子排布为1s22s22p2,则A为C元素;C、D同主族,且D的原子序数是C的2倍,则C为O,D为S元素;B介于C、O之间,则B为N元素;E是第四周期ds区不活泼金属元素,则E为Cu元素,据此解答。
根据分析可知:A为C元素,B为N元素,C为O,D为S,E为Cu元素。
(1)Cu+核外电子排布式为1s22s22p63s23p63d10,SO42-离子中S原子孤电子对数=![]() ,价层电子对数4+0=4,空间构型为正四面体,故答案为:1s22s22p63s23p63d10;正四面体;
,价层电子对数4+0=4,空间构型为正四面体,故答案为:1s22s22p63s23p63d10;正四面体;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能大小顺序为N>O>C,故答案为:N>O>C;
(3)S的原子序数为16,为元素周期表中第3周期ⅥA族;能导电的A单质为石墨,属于混合晶体,沸点很高,氮气常温下为气体,硫为分子晶体,沸点比较低,Cu为金属晶体,沸点比硫单质高,则熔点由高到低的排列顺序是:C>Cu>S>N2,故答案为:第3周期ⅥA族;C>Cu>S>N2;
(4)亚甲基中C原子形成4个σ键、C=O中C原子形成3个σ键,均没有孤对电子,则碳原子的轨道杂化类型为sp3、sp2,故答案为:sp3、sp2;
(5)(CN)2为共价化合物,分子中含有2个C≡N键和1个C-C键,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。

【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定,其实验装置如图所示.
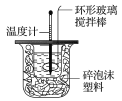
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):___________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________________________(取小数点后一位)。
(4)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是____________(填字母)。
a 实验装置保温、隔热效果差
b 量取NaOH溶液的体积时仰视读数
c 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
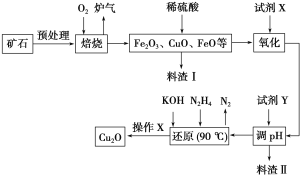
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。