题目内容
(14分)X,Y,Z,Q,R是五种短周期元素,原子序数依次增大。X,Y两元素最高正价与最低负价代数和均为0;Q与X同主族;Z是地壳中含量最高的非金属元素,R的简单离子在同周期离子中半径最小。请回答下列问题:
(1)画出Z的原子结构示意图 ,工业上制取R单质的化学方程式为
(2)已知,由X,Y两种元素组成的相对分子质量最小的化合物W 3.2g在氧气中完全燃烧生成稳定化合物(常温常压下)放出178.06KJ的热量,写出W燃烧的热化学方程式
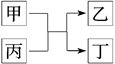
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系: (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为
②如果A,B均为由以上某些元素组成的盐,则A溶液显 性,原因是(用离子方程式表示) 。浓度均为0.1mol/L的A,B的溶液等体积混合,混合溶液中离子浓度由大到小的顺序为 。
(1) 2Al2O3
2Al2O3 4Al+3O2↑
4Al+3O2↑
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ?H=—890.3KJ/mol
(3)O=C=O 
①AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
②碱 CO32-+H2O HCO3-+OH- c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
HCO3-+OH- c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
解析

铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。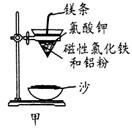
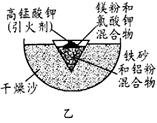

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。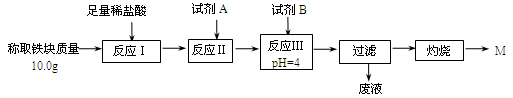
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
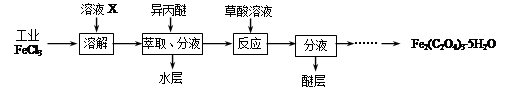
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
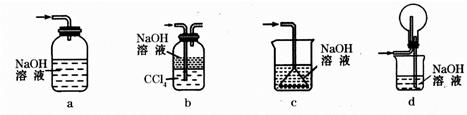
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
| |
正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为
0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
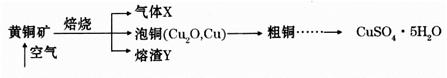
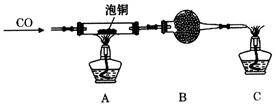
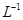 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: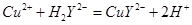 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
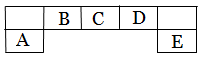
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。