题目内容
7.已知短周期元素的离子aA2+、bB+、cC2?、dD?都具有相同的电子层结构,则下列叙述正确的是( )| A. | 原子半径A>B>C>D | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 单质的还原性A>B离子的还原性C2?>D? |
分析 短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,
A、A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故A错误;
B、aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,所以原子序数为a>b>d>c故B错误;
C、aA2+、bB+、cC2-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径C2->D->B+>A2+,故C正确;
D、同周期自左而右元素金属性减弱,单质还原性减弱,则单质的还原性:B>A,同周期自左而右元素非金属性增强,阴离子的还原性减弱,则还原性为C2?>D?,故D错误;
故选C.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
3.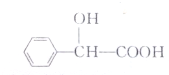 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )
 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )| A. | 该物质的分子式为C8H8O3 | |
| B. | 该物质分子中的8个碳原子都在同一个平面上 | |
| C. | 该物质既可以发生酯化反应又可以发生缩聚反应 | |
| D. | 1mol该物质可以与2mol金属Na反应 |
18.(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图1.下列说法正确的是ac(填序号字母)
a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ

(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(l)+H2O(g)△H<0t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
①70min时,平均反应速率υ (CO2 )=5.7×10-4mol/L•min.
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 0<V≤44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.
a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ

(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(l)+H2O(g)△H<0t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 0<V≤44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.
15.下列说法正确的是:( )
①电解质在水中电离时都存在电离平衡;
②升高温度,KW增大,纯水pH不变;
③加水稀释醋酸溶液能促进醋酸电离;
④25℃向水中加入少量稀硫酸,c(H+)增大,KW不变;
⑤氯水和食盐水都能导电,所以Cl2和NaCl都是电解质;
⑥升高温度能促进弱电解质的电离;
⑦强电解质溶液的导电能力比弱电解质溶液的导电能力强.
①电解质在水中电离时都存在电离平衡;
②升高温度,KW增大,纯水pH不变;
③加水稀释醋酸溶液能促进醋酸电离;
④25℃向水中加入少量稀硫酸,c(H+)增大,KW不变;
⑤氯水和食盐水都能导电,所以Cl2和NaCl都是电解质;
⑥升高温度能促进弱电解质的电离;
⑦强电解质溶液的导电能力比弱电解质溶液的导电能力强.
| A. | ①②⑤⑦ | B. | ②③④⑤⑥ | C. | ③④⑥ | D. | ②③④⑥⑦ |
2.在一定条件下,对于密闭容器中进行的反应:X(g)+3Y(g)?2Z(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
| A. | X、Y、Z的浓度相等 | B. | X、Y、Z在容器中共存 | ||
| C. | 正、逆反应速率都等于零 | D. | X、Y、Z的浓度均不再改变 |
12.核磁共振氢谱是测定有机分子结构最有用的工具之一.在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)不同.根据峰值(信号)可以确定有机物中氢原子的种类.下列有机物分子中,在核磁共振氢谱中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | (CH3)3CCH2CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
19.关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
17.常温下,下列事实可证明氨水是弱碱的是( )
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 0.1mol/L氯化铵溶液的pH约为5 | |
| C. | 0.1mol/L氨水可以使酚酞试液变红 | |
| D. | 铵盐受热易分解 |