题目内容
(Ⅰ)(4分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)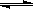 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
该反应的△H 0。(填“>”、“=”或“<”)
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g)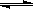 2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
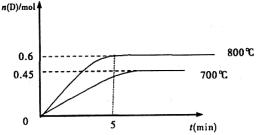
(Ⅱ)(5分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)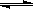 C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(3)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)
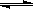 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g)
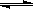 2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)(Ⅱ)(5分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)
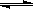 C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(3)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)A(1分)
(2)>(1分)
(3)设NO的平衡浓度为x
N2(g) + O2(g)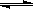 2NO(g)
2NO(g)
起始时各物质浓度/ mol·L-1: 2.6 2.6 0
平衡时各物质浓度/ mol·L-1 2.6-x/2 2.6-x/2 x

x=0.20 mol·L-1(2分)
(Ⅱ)(1)AB(2分,漏一个扣1分,错选不得分)
(2)0.9(mol·L—1)—1(单位可不写) 吸热(2分)
(3)向正反应方向(1分)
(2)>(1分)
(3)设NO的平衡浓度为x
N2(g) + O2(g)
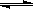 2NO(g)
2NO(g)起始时各物质浓度/ mol·L-1: 2.6 2.6 0
平衡时各物质浓度/ mol·L-1 2.6-x/2 2.6-x/2 x

x=0.20 mol·L-1(2分)
(Ⅱ)(1)AB(2分,漏一个扣1分,错选不得分)
(2)0.9(mol·L—1)—1(单位可不写) 吸热(2分)
(3)向正反应方向(1分)
(1)氮气分子内的氮氮三键,键能极大,导致反应的活化能特别高,需要外界提供足够的能量才能发生化学反应;
(2)升高温度,K值增大,平衡右移,说明正反应为吸热反应,△H>0
(3)设NO的平衡浓度为x
N2(g) + O2(g)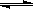 2NO(g)
2NO(g)
起始时各物质浓度/ mol·L-1: 2.6 2.6 0
平衡时各物质浓度/ mol·L-1 2.6-x/2 2.6-x/2 x

x=0.20 mol·L-1(2分)
(Ⅱ)(1)在恒容条件下:
A.该可逆反应的两边的气体系数不等,故气体的总物质的量为变量,容器内的压强也是变量,当不变时,说明已达到平衡状态,正确
B.混合气体中c(A)不变,则各物质浓度均将不变,符合平衡状态的特征,正确
C.以不同物质的来表示正逆反应速率时,两速率数值上应符合系数比才能表示达到平衡,排除
D.不能说明任何问题,排除
答案为AB
(2)反应:A(g)+2B(g)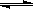 C(g)+D(g)
C(g)+D(g)
初n: 1.0 2.2 0 0
△n: 0.6 1.2 0.6 0.6
平衡n: 0.4 1.0 0.6 0.6
800℃时的平衡常数K= =0.9(mol·L—1)—1
=0.9(mol·L—1)—1
由图示可知,升温时,D的量增大,平衡右移,正反应为吸热反应;
(3)依据所给数据可求得700℃时K=0.28,而此时刻的 =0.11,故反应将向正反应方向移动。
=0.11,故反应将向正反应方向移动。
(2)升高温度,K值增大,平衡右移,说明正反应为吸热反应,△H>0
(3)设NO的平衡浓度为x
N2(g) + O2(g)
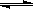 2NO(g)
2NO(g)起始时各物质浓度/ mol·L-1: 2.6 2.6 0
平衡时各物质浓度/ mol·L-1 2.6-x/2 2.6-x/2 x

x=0.20 mol·L-1(2分)
(Ⅱ)(1)在恒容条件下:
A.该可逆反应的两边的气体系数不等,故气体的总物质的量为变量,容器内的压强也是变量,当不变时,说明已达到平衡状态,正确
B.混合气体中c(A)不变,则各物质浓度均将不变,符合平衡状态的特征,正确
C.以不同物质的来表示正逆反应速率时,两速率数值上应符合系数比才能表示达到平衡,排除
D.不能说明任何问题,排除
答案为AB
(2)反应:A(g)+2B(g)
 C(g)+D(g)
C(g)+D(g)初n: 1.0 2.2 0 0
△n: 0.6 1.2 0.6 0.6
平衡n: 0.4 1.0 0.6 0.6
800℃时的平衡常数K=
 =0.9(mol·L—1)—1
=0.9(mol·L—1)—1由图示可知,升温时,D的量增大,平衡右移,正反应为吸热反应;
(3)依据所给数据可求得700℃时K=0.28,而此时刻的
 =0.11,故反应将向正反应方向移动。
=0.11,故反应将向正反应方向移动。
练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
 mZ(g) ΔH=-a kJmol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
mZ(g) ΔH=-a kJmol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是 pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )
pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )
 bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则:
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则: 2HBr(g),能说明反应已达平衡状态的是 ( )
2HBr(g),能说明反应已达平衡状态的是 ( ) zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白: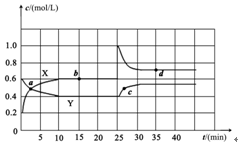
 pC(g) △H=?反应情况记录如下表:
pC(g) △H=?反应情况记录如下表: CO2(g)+ H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为
CO2(g)+ H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是 :
2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是 :