题目内容
(2010?崇文区一模)25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )
分析:A.从溶液的电荷守恒的角度分析;
B.pH相等相等时,酸越弱,对应的盐的浓度越小;
C.如HA为强酸,则反应后呈中性,如为弱酸,反应后呈酸性;
D.c(Cl-)应大于c(NH+4).
B.pH相等相等时,酸越弱,对应的盐的浓度越小;
C.如HA为强酸,则反应后呈中性,如为弱酸,反应后呈酸性;
D.c(Cl-)应大于c(NH+4).
解答:解:A.溶液存在电荷守恒,应为c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故A错误;
B.因酸性CH3COOH>H2CO3,pH相等相等时,酸越弱,对应的盐的浓度越小,则pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),故B正确;
C.如HA为强酸,则反应后呈中性,如为弱酸,反应后呈酸性,应存在c(H+)≥c(OH-),故C错误;
D.0.4mol/L NH4Cl和0.2mol/L NaOH两种溶液等体积混合,c(Cl-)应大于c(NH+4),故D错误.
故选B.
B.因酸性CH3COOH>H2CO3,pH相等相等时,酸越弱,对应的盐的浓度越小,则pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),故B正确;
C.如HA为强酸,则反应后呈中性,如为弱酸,反应后呈酸性,应存在c(H+)≥c(OH-),故C错误;
D.0.4mol/L NH4Cl和0.2mol/L NaOH两种溶液等体积混合,c(Cl-)应大于c(NH+4),故D错误.
故选B.
点评:本题考查离子浓度大大小比较,题目难度中等,注意把握弱电解质和盐类水解的特点,结合电荷守恒解答该类题目.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
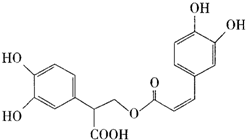 (2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )
(2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )

