��Ŀ����
����Ŀ����ȸʯ��Ҫ��Cu2(OH)2CO3���Լ�����Fe��Si�Ļ���������ÿ�ȸʯΪԭ���Ʊ�����( CuSO4��5H2O)���������£�
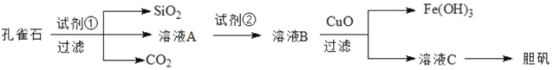
�ش��������⣺
(1)�Լ�����һ�ֳ������ᣬ�仯ѧʽΪ______����������Ҫ�IJ����������ձ���__________��
(2)ʵ���Ҽ��� Fe3+�ij��÷�����_____________________________________ ��
(3)����ҺA�еĽ���������Cu2+��Fe2+ ��Fe3+��������������Ҫ���Լ��ڽ���ҺA�е�Fe2+ȫ��ת��ΪFe3+���Ӷ��γ���Һ B,���Լ����ܷ�ʹ����ˮ������ܡ����ܡ���������ܡ��������ԭ��_________________
(4)����ҺC��õ�������Ҫ����_______��_____�����˵Ȳ�����
(5)ȡ25.00mL��ҺA,��1.000��10-2mol/L�� KMnO4����Һ�ζ�����Ӧ���ӷ���ʽΪ��5Fe2++ MnO4-+8H+=5Fe3+ Mn2+ +4H2O�������ı���Һ 20.00mL������ҺA ��Fe2+��Ũ��Ϊ_________mol/L��
���𰸡�H2SO4 ©���������� ����Һ�еμ�KSCN��Һ������Ѫ�죬����Fe3+ ���ܣ������������� ����Ũ�� ��ȴ�ᾧ 0.040
��������
��ȸʯ��Ҫ��Cu2(OH)2CO3���Լ�����Fe��Si�Ļ�������ȸʯ�м����Լ���Ϊϡ���ᣬ�����ķ�Ӧ��Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2������������������ϡ�������������������������κ�ˮ�����˵õ�������ΪSiO2������ҺA�м����Լ��ڵõ���ҺB���Լ���Ӧ��һ������������Fe2+ת��ΪFe3+�Ҳ����������ʣ�Ӧ��ѡȡ˫��ˮ����ҺB�к�������������ͭ������ҺB�м���CuO���õ���ҺC��Fe(OH)3�����˵õ���ҺCΪ����ͭ��Һ���������ᾧ�ɵõ�������
��1���Լ�����һ�ֳ������ᣬ�Ա������������ʣ�ӦΪϡ���ᣬ�仯ѧʽΪ��H2SO4����������Ҫ�IJ���������©�����ձ������������ʴ�Ϊ��H2SO4��©������������
��2�����������ӣ���ȡ���������еμ�KSCN��Һ����Һ��Ѫ��ɫ������Fe3+���ʴ�Ϊ������Һ�еμ�KSCN��Һ������Ѫ�죬����Fe3+��
��3�����ܼ�����ˮ���������Ȼ�ͭ�����������ʣ��ʴ�Ϊ�����ܣ������������ʡ�
��4������ҺC��õ�������Ҫ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ʴ�Ϊ������Ũ������ȴ�ᾧ��
��5��n(KMnO4)=1.000��102mol/L��0.02L=2.000��104mol�����ӷ���ʽΪ��5Fe2++ MnO4-+8H+=5Fe3+ Mn2+ +4H2O��֪��n(Fe2+)=1.000��103mol������ҺA��Fe2+��Ũ��Ϊ0.001mol/0.025L=0.040mol/L���ʴ�Ϊ��0.040��

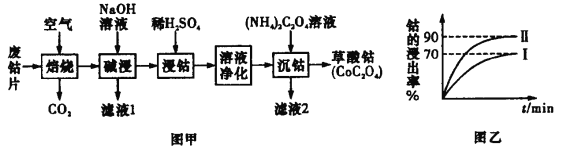
����Ŀ���Ͼ��ܽ���Ƭ�е����У�2 �ۺͣ�3 �ۣ��������̡������ơ�þ�����Ƚ���Ԫ�ؼ�̼�۵ȣ��� ���ܵĹ������̣�
��֪���ٱ��պ� Mn Ԫ�صĻ��ϼ�Ϊ+2
��
���� | MgF2 | CaF2 | CoF2 | MgC2O4 | CaC2O4 | CoC2O4 |
�ܶȻ� | 4��10��9 | 5.3��10��9 | 4��10��3 | 5��10��6 | 6.4��10��9 | 1.7��10��7 |
(1)����ʱΪ��ʹ�Ͼ��ܽ���Ƭ��ַ�Ӧ���ɲ�ȡ�Ĵ�ʩ��_____________����дһ������
(2)��Һ 1 ���е��������� ____________ ��
(3)�������н���ʱ���ܵĽ��������ֻ�ܴﵽ 70���������Ľ�����������ʹ��������е�һ�ν�ȡ�� �ټ��� Na2SO3 ��Һ���еڶ��ν�ȡ���Ӷ�ʹ�ܵĽ����ʴ� 90�����ϣ�д���ڶ��ν�����ʱ��Һ�з����� Ӧ�����ӷ���ʽ��___________________
(4)������Һ�IJ����к��ж�����裬�ȳ�������̡�
�ٳ����������£�������Һ pH Ϊ 1��5��2��0 �� H2O2����Ӧһ��ʱ�䣬�� 8��Na2CO3 ��Һ������Һ �� pH ���� 4��0��5��0�����û�ѧƽ���ƶ�ԭ�����ͼ��� Na2CO3 ��Һ�ܳ�ȥ��Һ����Ԫ�ص�ԭ��____________��
�ڳ��̣����� NaClO ��Һ��д�������ӷ���ʽ��___________________��
�ۼ���þ������ NH4F ��Һ�������ֵĸơ�þ�����ӡ� �Խ���Ϊ�β������Һ����ǰҪ����þ��_____��
(5)������ѧ��ѧ��ȤС����̽�� CoC2O42H2O ���Ⱥ�ķֽ���ȡ 5.49gCoC2O42H2O��Ħ������Ϊ183g/mol����Ӳ�ʲ������м���һ��ʱ�䣬��ȴ��������ʣ����������������Ϊ 2.41g����д CoC2O42H2O���ȷֽ�Ļ�ѧ����ʽ___________________________________��
����Ŀ����֪ij��ȼ�Ϻ���̼���⡢������Ԫ�ء�Ϊ�˲ⶨ����ȼ����̼��������Ԫ�ص������ȣ��ɽ���̬ȼ�Ϸ���������O2��ȼ�գ���������������ȫ��ͨ��ͼʾװ�ã��õ�������е�ʵ������(������������ȫ������)��

ʵ��ǰ | ʵ��� | |
(�������U�ι�)������ | 101.1g | 102.9g |
(����ʯ��ˮ�����ƿ)������ | 312.0g | 314.2g |
����ʵ��������գ�
��1��ʵ����Ϻ���������ˮ������Ϊ____g��������ƿ������һ�����Σ�������Ϊ______g��
��2�����ɵ�ˮ����Ԫ�ص�����Ϊ________g��
��3�����ɵ�CO2��̼Ԫ�ص�����Ϊ________g��
��4����ȼ����̼����Ԫ��������Ϊ________��