题目内容
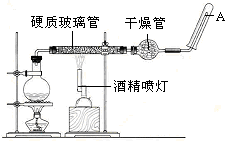
7.在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率.某研究小组用图1装置模拟生产过程中测定SO2转化成SO3的转化率.已知SO3的熔点是16.8℃,沸点是44.8℃.发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O
(1)Ⅱ中的试剂是,仪器Ⅵ的名称为分别为浓硫酸、干燥管.
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置.请从图2A~D装置中选择最适合装置并将其序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是C、D.
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先②后①(填编号).
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是SO3易挥发,极易溶于水.
(5)用12.6gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了4.48g,则实验测得SO2的转化率为30%.
分析 (1)二氧化硫的干燥用浓硫酸,根据仪器的结构知道仪器Ⅵ的名称为干燥管;
(2)当温度低于 16.8℃可以获得三氧化硫的晶体,尾气处理用碱石灰;
(3)先加热催化剂再滴入浓硫酸,能保证产生的二氧化硫尽可能多的转化为三氧化硫;
(4)SO3溶于水生成硫酸;
(5)根据S元素守恒计算消耗的物质的量,可计算转化率.
解答 解:(1)SO2转化成SO3之前必须对二氧化硫进行干燥,可以用浓硫酸,根据仪器的结构知道仪器Ⅵ的名称为干燥管,
故答案为:浓硫酸;干燥管;
(2)SO3的熔点是16.8℃,沸点是44.8℃,当温度低于 16.8℃时,三氧化硫以晶体状态存在,二氧化硫、三氧化硫的尾气处理用烧碱溶液吸收,
故答案为:C、D;
(3)为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再滴入浓硫酸,
故答案为:②①;
(4)SO3易挥发,极易溶于水生成硫酸成大量的白雾,
故答案为:SO3易挥发,极易溶于水;
(5)根据元素守恒Na2SO3~SO2,则12.6gNa2SO3(即0.1mol)会生成二氧化硫0.1mol,装置Ⅴ增重了4.48g,说明剩余的二氧化硫为4.48g(即0.07mol),所以二氧化硫的转化率=$\frac{0.1mol-0.07mol}{0.1mol}$×100%=30%,
故答案为:30%.
点评 本题主要考查了二氧化硫的性质以及离子的检验等知识,综合性较强,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
17.常见的大气污染物分一次污染物和二次污染物.二次污染物是排放环境中的一次污染物在物理、化学因素或生物作用下发生了变化,或与环境中的其他物质发生反应生成的新污染物.如2NO+O2═2NO2,则NO2就是二次污染物,由NO2导致的污染就是NO的二次污染.下列物质中:①SO2,②NO,③NO2,④HCl,⑤CO2,不易导致二次污染的是( )
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ④⑤ | D. | ④ |
18.常温下,某溶液中仅含表离子中的5种离子,且离子的物质的量均为1mol
①若向原溶液中加入KSCN溶液,无明显变化.
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变.
③若向原溶液中加入BaCl2溶液,有白色沉淀生成.
④若向原溶液中加入足量NaOH溶液至阳离子恰好沉淀完全,充分反应后静置一段时间,过滤、洗涤、烧灼、最终所得固体的质量为ag.下列说法正确的是( )
| 阴离子 | SO42-、NO3-、CO32-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变.
③若向原溶液中加入BaCl2溶液,有白色沉淀生成.
④若向原溶液中加入足量NaOH溶液至阳离子恰好沉淀完全,充分反应后静置一段时间,过滤、洗涤、烧灼、最终所得固体的质量为ag.下列说法正确的是( )
| A. | 若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象为有血红色沉淀生成 | |
| B. | 原溶液中含有的阳离子为Fe2+、Al3+ | |
| C. | 用排水法可收集所产生的气体体积为$\frac{22.4}{3}$L | |
| D. | a=160 |
15.在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有表中的若干种离子:
取该溶液10mL进行如下实验(气体体积在标准状况下测定):
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是Ag+、Mg2+、Ba2+.
(2)实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
(4)判断K+是否存在存在,(填“是”或“否”)若存在求其最小浓度,若不存在说明理由其浓度至少为0.8mol/L.
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3、CO32-、SO42-、SiO32- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是Ag+、Mg2+、Ba2+.
(2)实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
(4)判断K+是否存在存在,(填“是”或“否”)若存在求其最小浓度,若不存在说明理由其浓度至少为0.8mol/L.
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LCl2溶于水,Cl2和水反应时转移电子数为NA | |
| B. | 标准状况下,40gSO3中含有分子的数目为0.5NA | |
| C. | 标准状况下,2.24L由乙烯和聚乙烯组成的混合物中含有原子的数目为0.6NA | |
| D. | 常温常压下,10g46%酒精水溶液中含氧原子总数为0.1NA |

 ;F、G、M三种元素最高价氧化物对应的水化物碱性最强的是Ca(OH)2(填化学式).
;F、G、M三种元素最高价氧化物对应的水化物碱性最强的是Ca(OH)2(填化学式).