题目内容
【题目】纯碱是一种非常重要的化学基本工业产品,工业上有很多不同的方法生产纯碱。
Ⅰ、路布兰法——其生产原理:用硫酸将食盐转化为硫酸钠,将硫酸钠与木炭、石灰石一起加热,得到产品和硫化钙。
(1)请写出上述过程的化学方程式:____________。
Ⅱ.索尔维制碱法:以食盐、氨气(来自炼焦副产品)和二氧化碳(来自石灰石)为原料,首先得到小苏打,再加热分解小苏打,获得纯碱。
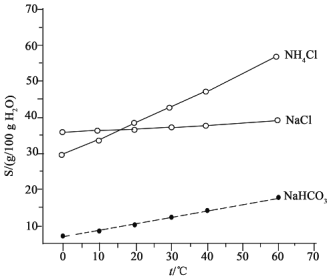
(2)结合下图中所给物质的溶解度曲线。写出得到小苏打的离子方程式:____________。
(3)这种生产方法的优点是原料便宜、产品纯度高、氨和部分二氧化碳可以循环使用。请写出实现氨循环的化学方程式:____________。
Ⅲ.侯德榜制碱法——生产流程可简要表示如下:
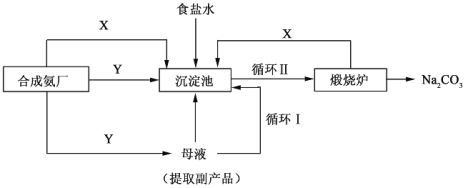
(4)合成氨工厂需要向制碱厂提供两种原料气体,其中Y是____________(填化学式),这两种气体在使用过程中是否需要考虑通入的先后顺序____________(填”是”或“否”),原因是____________。
(5)侯德榜制碱法保留了索尔维法的优点,克服了它的缺点,特别是设计了____________(填流程中的编号)使原料中溶质的利用率从70%提高到了96%以上。从母液中可以获得的副产品的应用:____________(举一例)。
(6)该合成氨厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其它损耗)的____________%(保留两位有效数字)。
【答案】
I.(1)2NaC1+H2SO4(浓)![]() Na2SO4+2HC1↑、Na2SO4+2C十CaCO3
Na2SO4+2HC1↑、Na2SO4+2C十CaCO3![]() CaS+Na2CO3+2CO2↑
CaS+Na2CO3+2CO2↑
II.(2)Na++NH3+H2O+CO2![]() NaHCO3↓+NH4+
NaHCO3↓+NH4+
(3)2NH4C1+Ca(OH)2![]() CaC12+2NH3↑+2H2O
CaC12+2NH3↑+2H2O
III.(4)NH3;是;氨气在食盐水中溶解度大,先通氨气再通入CO2会产生碳酸氢铵,有利于碳酸氢铵的析出
(5)循环I;作化肥(合理答案即可)
(6)54
【解析】
试题分析:Ⅰ、(1)根据用硫酸将食盐转化为硫酸钠,将硫酸钠与木炭、石灰石一起加热,得到产品和硫化钙,上述过程的化学方程式为2NaC1+H2SO4(浓)![]() Na2SO4+2HC1↑、Na2SO4+2C+CaCO3
Na2SO4+2HC1↑、Na2SO4+2C+CaCO3![]() CaS+Na2CO3+2CO2↑,故答案为:2NaC1+H2SO4(浓)
CaS+Na2CO3+2CO2↑,故答案为:2NaC1+H2SO4(浓)![]() Na2SO4+2HC1↑、Na2SO4+2C+CaCO3
Na2SO4+2HC1↑、Na2SO4+2C+CaCO3![]() CaS+Na2CO3+2CO2↑;
CaS+Na2CO3+2CO2↑;
Ⅱ.(2)根据溶解度曲线,碳酸氢钠溶解度较小,反应生成小苏打的离子方程式为Na++NH3+H2O+CO2![]() NaHCO3↓+NH4+,故答案为:Na++NH3+H2O+CO2
NaHCO3↓+NH4+,故答案为:Na++NH3+H2O+CO2![]() NaHCO3↓+NH4+;
NaHCO3↓+NH4+;
(3)生成的氯化铵与碱能够反应生成氨气,因此实现氨循环的化学方程式为2NH4C1+Ca(OH)2![]() CaC12+2NH3↑+2H2O,故答案为:2NH4C1+Ca(OH)2
CaC12+2NH3↑+2H2O,故答案为:2NH4C1+Ca(OH)2![]() CaC12+2NH3↑+2H2O;
CaC12+2NH3↑+2H2O;
Ⅲ.(4)合成氨工厂需要向制碱厂提供的两种原料气体为二氧化碳和氨气,根据流程图,Y是氨气;二氧化碳的溶解度不大,氨气极易溶于水,因此先通氨气再通入CO2会产生碳酸氢铵,有利于碳酸氢铵的析出,故答案为:NH3;是;氨气在食盐水中溶解度大,先通氨气再通入CO2会产生碳酸氢铵,有利于碳酸氢铵的析出;
(5)侯德榜制碱法保留了索尔维法的优点,克服了它的缺点,特别是设计了循环I,使原料中溶质的利用率从70%提高到了96%以上。从母液中可以获得氯化铵,可以用作化学肥料,故答案为:循环I;作化肥;
(6)由NH3制NO的产率是94%、NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为![]() ×100%=54%;即制HNO3所用去的NH3的质量占总耗NH3质量的54%,故答案为:54。
×100%=54%;即制HNO3所用去的NH3的质量占总耗NH3质量的54%,故答案为:54。