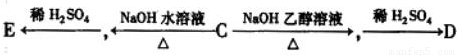题目内容
已知Ag+与Cl-反应生成AgCl,每次生成的AgCl有10%见光分解成单质银和氯气,Cl2又可与水反应生成HClO3和HCl,其中生成的HCl又与剩余的Ag+作用生成AgCl,这样循环往复直至最终。(1)写出上述各步反应的化学方程式。
(2)现有含1.1 mol NaCl的溶液,加入足量的AgNO3溶液,则最终能生成多少克难溶物(Ag和 AgCl)?若最后溶液的体积为1 L,则H+的物质的量浓度为多少?
答案:
解析:
解析:
| (1)AgNO3+NaCl=AgCl↓+NaNO3
2AgCl 3Cl2+3H2O=5HCl+HClO3 HCl+AgNO3=AgCl↓+HNO3 (2)167.94g;0.12mol/L。利用等比数列,公比为
|

练习册系列答案
相关题目
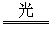 2Ag+
2Ag+ .(已知:
.(已知: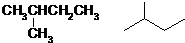 )
)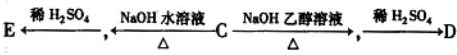
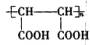
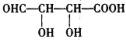 或
或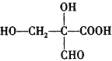
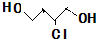
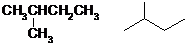
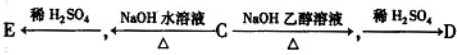
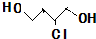 .(已知:
.(已知: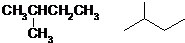 )
)