题目内容
11.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )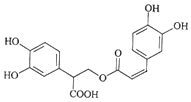
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸与溴水反应时最多消耗6molBr2 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1mol迷迭香酸与NaOH的水溶液完全反应时最多消耗5molNaOH |
分析 由结构可知,分子中含酚-OH、碳碳双键、-COOH、-COOC-,结合酚、烯烃、羧酸、酯的性质来解答.
解答 解:A.含O元素,不属于芳香烃,故A错误;
B.酚-OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,则1mol迷迭香酸与溴水反应时最多消耗7molBr2,故B错误;
C.-COOC-可发生水解、取代反应,含-OH、-COOH可发生酯化反应,故C正确;
D.4个酚-OH、1个-COOH、1个-COOC-与NaOH反应,1mol迷迭香酸与NaOH的水溶液完全反应时最多消耗6molNaOH,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意酚、烯烃、酯的性质应用,题目难度不大.

练习册系列答案
相关题目
1.除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤;
②加过量NaOH溶液;
③加适量盐酸;
④加过量Na2CO3溶液;
⑤加过量BaCl2溶液.
①过滤;
②加过量NaOH溶液;
③加适量盐酸;
④加过量Na2CO3溶液;
⑤加过量BaCl2溶液.
| A. | ⑤②④①③ | B. | ①④②⑤③ | C. | ④②⑤ | D. | ④①②⑤③ |
2.将NaCl、AlCl3、FeCl2、FeCl3、MgCl2五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
19.下列溶液中,只用试管和胶头滴管,不用其他任何试剂就可鉴别的是( )
| A. | KOH和Al2(SO4)3 | B. | Ca(OH)2溶液和NaHCO3 | ||
| C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
6.在体积不变的400℃恒温密闭容器中,一定量的二氧化硫和氧气在催化剂作用下发生反应:
2SO2(g)+O2$?_{加热}^{催化剂}$2SO3(g)+QkJ,下列叙述错误的是( )
2SO2(g)+O2$?_{加热}^{催化剂}$2SO3(g)+QkJ,下列叙述错误的是( )
| A. | 增大压强,该反应正、逆反应速率可能不变 | |
| B. | 降低温度,正反应速率比逆反应速率减小的程度小 | |
| C. | 若将三氧化硫分离出,则平衡正向移动,平衡常数K值增大 | |
| D. | 若气体的物质的量减少0.5 mol时达到平衡,则该条件下反应放出0.5 Q KJ的热量 |
16.某元素的一个原子形成的离子可表示为An-,该离子含有X个中子和Y个电子.则一个A原子的实际质量表示为( )
| A. | (X+Y+n)g | B. | (X+Y-n)g | C. | (X+Y-n)/NA g | D. | (X+Y+n)/NAg |
20.“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础.
(1)过氧化钙(CaO2)难溶于水,广泛应用于渔业、农业、环保等方面,其制备方法如下:
①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应,写出该可逆反应的化学方程式H2O2+CaCl2?CaO2+2HCl.
②测得不同温度下,过氧化钙的平均生成速率如表所示:
请解释速率随温度如此变化的原因40℃之前,温度升高,速率加快;40℃之后,温度继续升高,双氧水分解,浓度下降,反应速率减慢 .
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O .
(3)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol.
已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ•mol-1 ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ•mol-1 ③
(4)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g)?CH4(g)+H2O (g)△H<0.一定温度下,把1molCO和3molH2加入到体积为1L的密闭容器中,测得不同时间CO的体积分数φ(CO)如表:
①一定条件下,下列能说明该反应达到平衡状态的是bd.
a.混合气体的密度不再变化 b.容器内压强不再变化
c.v (CH4)=v (CO) d.CO在混合气中的质量分数保持不变
②对于基元反应aA+bB?cC+dD而言,其某一时刻的瞬时速率计算公式如下:正反应速率为v正=k正•c(A)a•c(B)b;逆反应速率为v逆=k逆•c(C)c•c(D)d,其中k正、k逆为速率常数.若将上述反应视为基元反应,反应进行到35min时k逆:k正=0.0036.
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为NaCN+H2S=HCN+NaHS.在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020mol•L-1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol•L-1时,Mn2+开始沉淀,则a=5.[已知:Ksp(MnS)=1.4×10-15].
(1)过氧化钙(CaO2)难溶于水,广泛应用于渔业、农业、环保等方面,其制备方法如下:
①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应,写出该可逆反应的化学方程式H2O2+CaCl2?CaO2+2HCl.
②测得不同温度下,过氧化钙的平均生成速率如表所示:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O .
(3)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol.
已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ•mol-1 ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ•mol-1 ③
(4)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g)?CH4(g)+H2O (g)△H<0.一定温度下,把1molCO和3molH2加入到体积为1L的密闭容器中,测得不同时间CO的体积分数φ(CO)如表:
| t/min | 0 | 10 | 20 | 30 | 40 |
| φ(CO) | 0.250 | 0.235 | 0.225 | 0.200 | 0.200 |
a.混合气体的密度不再变化 b.容器内压强不再变化
c.v (CH4)=v (CO) d.CO在混合气中的质量分数保持不变
②对于基元反应aA+bB?cC+dD而言,其某一时刻的瞬时速率计算公式如下:正反应速率为v正=k正•c(A)a•c(B)b;逆反应速率为v逆=k逆•c(C)c•c(D)d,其中k正、k逆为速率常数.若将上述反应视为基元反应,反应进行到35min时k逆:k正=0.0036.
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为NaCN+H2S=HCN+NaHS.在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020mol•L-1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol•L-1时,Mn2+开始沉淀,则a=5.[已知:Ksp(MnS)=1.4×10-15].
7.下表为元素周期表的一部分:
请回答下列问题:
(1)Z元素在周期表中的位置为第三周期ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是ac(填序号).
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)现有一定量的铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol•L-1 NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为NO:0.9mol,NO2:1.3mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是ac(填序号).
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)现有一定量的铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol•L-1 NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为NO:0.9mol,NO2:1.3mol,生成硫酸铜物质的量为2mol.