题目内容
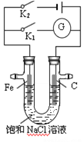
【题目】如图所示进行实验,下列说法不正确的是
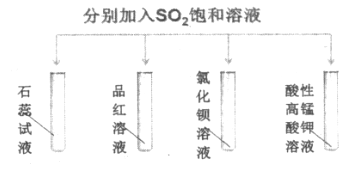
A. 石蕊试液变红说明SO2的水溶液显酸性
B. 品红溶液、酸性高锰酸钾溶液褪色原因不相同
C. BaCl2溶液中开始没有明显现象,一段时间后缓慢出现浑浊,该浑浊为BaSO3
D. 该实验说明SO2的性质具有多样性
【答案】C
【解析】A. 二氧化硫和水反应生成亚硫酸是中强酸,能够使石蕊试液变红;B.SO2具有漂白性,使品红褪色,具有还原性,使酸性高锰酸钾溶液褪色;C.亚硫酸的酸性小于盐酸,所以BaCl2溶液与SO2不反应;D.该实验综合体现了SO2的酸性氧化物的性质、漂白性、还原性等性质。
SO2和水反应生成H2SO3, H2SO3电离出H+而使其溶液呈酸性,酸能使紫色石蕊试液变红色,A正确;二氧化硫具有漂白性可以使品红溶液褪色,所以品红溶液中不断的通入SO2气体,品红溶液褪色,说明SO2具有漂白性;高锰酸钾溶液具有氧化性,能氧化还原性物质,向其中通入SO2溶液褪色,则高锰酸钾被还原,所以说明+4价硫具有还原性, SO2具有还原性, 褪色原因不相同,B正确;盐酸的酸性大于亚硫酸的酸性,因此BaCl2溶液与SO2气体不能发生反应,没有现象出现,C错误;通过以上实验证明SO2具有酸性氧化物的性质、漂白性、还原性等性质,D正确;答案选C。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ. 向铝灰中加入过量稀H2SO4,过滤;
Ⅱ. 向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ. 加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ. 加入MnSO4至紫红色消失,过滤;
Ⅴ. 加热浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是__________________。
(2)KMnO4氧化Fe2+的离子方程式补充完整:_________________

(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的_______________;
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________。
②Ⅳ中加入MnSO4的目的是_____________________。