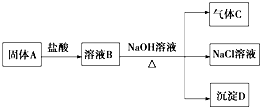
题目内容
17.我国于“十二五”期间将SO2的排放量减少8%,研究SO2的综合意义重大.已知25℃时:SO2(g)+2CO(g)=2CO2(g)+$\frac{1}{x}$Sx(s)△H=akJ/mol,2COS(g)+SO2(g)=2CO2(g)+$\frac{3}{x}$Sx(s)△H=bkJ/mol.则CO与Sx生成COS反应的热化学方程式是CO(g)+$\frac{1}{x}$Sx(s)=COS(g)△H=$\frac{a-b}{2}$KJ/mol.分析 已知:①SO2(g)+2CO(g)═2C02(g)+$\frac{1}{x}$Sx(s)△H=a kJ•mol-1;②2COS(g)+SO2(g)═2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ•mol-1,依据盖斯定律将(①×2-②)÷2得到CO与Sx生成COS反应的热化学方程式.
解答 解:①SO2(g)+2CO(g)═2C02(g)+$\frac{1}{x}$Sx(s)△H=a kJ•mol-1;
②2COS(g)+SO2(g)═2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ•mol-1,
依据盖斯定律(①×2-②)÷2得到:CO(g)+$\frac{1}{x}$Sx(s)=COS(g)△H=$\frac{a-b}{2}$KJ/mol,
故答案为:CO(g)+$\frac{1}{x}$Sx(s)=COS(g)△H=$\frac{a-b}{2}$KJ/mol.
点评 本题考查盖斯定律计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握盖斯定律的应用,把握计算思路.

练习册系列答案
相关题目
8.在密闭体积不变的真空容器中加入一定量纯净的氨基甲酸铵固体,(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g),已知25℃时,平衡气体总浓度为2.4×10-3mol•L-1,下列说法中正确的是( )
| A. | 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 | |
| B. | 20℃时,氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 | |
| C. | 恒温下压缩体积,NH3的体积分数不变 | |
| D. | 再加入一定量氨基甲酸铵,可加快正反应反应速率 |
5.燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量丙烯所产生的CO2的质量,该混合气体是( )
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
12.西维因是一种高效低毒杀虫剂,在碱性条件下可水解:则下列说法正确的是( )
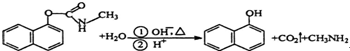

| A. | 西维因是一种芳香烃 | |
| B. | 西维因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化加热条件下西维因不能与H2加成 |
2.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
9.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图所示,则下列说法中正确的是( )
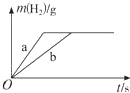

| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
6.下表是元素周期律的一部分.根据表中的10种元素,用元素符号或化学式填空.
(1)在 ①~⑩元素中金属性最强的金属元素是K;第一电离能最小的元素是K;电负性最强的元素是F
(2)在 ①~⑩元素的最高价氧化物的水化物呈两性的是Al(OH)3;⑥形成的最高价氧化物的水化物的分子式是HClO4;
(3)①形成的气态氢化物的结构式是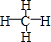 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
(2)在 ①~⑩元素的最高价氧化物的水化物呈两性的是Al(OH)3;⑥形成的最高价氧化物的水化物的分子式是HClO4;
(3)①形成的气态氢化物的结构式是
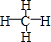 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体.