题目内容
【题目】按要求填空:
(1)有下列物质:①铜;②石灰水;③CO2;④Na2SO4固体;⑤CaO.其中属于混合物的是(填序号,下同),属于碱性氧化物的是;写出Na2SO4在水溶液中的电离方程式: .
(2)如图装置中仪器①的名称是 , 水流的方向是从(填“a”或“b”)口进入. 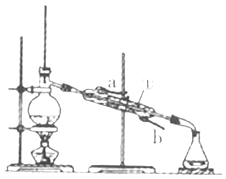
(3)实验室常用(填试剂)检验Fe3+的存在,现象是 .
(4)19g MgCl2中Mg2+的物质的量是mol.
【答案】
(1)②;⑤; Na2SO4=2Na++SO42﹣
(2)冷凝管; b
(3)KSCN溶液;溶液变为血红色
(4)0.2
【解析】解:(1)①铜是单质为纯净物;
②石灰水是氢氧化钙的水溶液为混合物;
③CO2是酸性氧化物为纯净物;
④Na2SO4固体为盐属于纯净物;
⑤CaO为纯净物,和酸反应生成盐和水为碱性氧化物;
其中属于混合物的是②,属于碱性氧化物的是⑤,Na2SO4在水溶液中的电离方程式为:Na2SO4=2Na++SO42﹣,
所以答案是:②;⑤;Na2SO4=2Na++SO42﹣;(2)装置中仪器①的名称是冷凝管,水流的方向是从b口进入,所以答案是:冷凝管;b;(3)检验Fe3+的存在用KSCN溶液,铁离子结合SCN﹣离子形成血红色溶液,所以答案是:KSCN溶液;溶液变为血红色;(4)19g MgCl2中Mg2+的物质的量:n(Mg2+)=n(MgO)= ![]() =0.2mol,
=0.2mol,
所以答案是:0.2;

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl36H2O)的工艺流程如图: 
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是 . 该反应的化学方程式 , 该反应中被氧化的元素是 .
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、;
(3)操作a为蒸发浓缩、冷却结晶、、、干燥,获得FeCl36H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
0.1 | 0.5 | 1 | 10 | |
400 | 99.2% | 99.6% | 99.7% | 99.9% |
500 | 93.5% | 96.9% | 97.8% | 99.3% |
600 | 73.7% | 85.8% | 89.5% | 96.4% |
根据表中的数据判断该反应的正向属于(填“放热“或”吸热“)反应,理由是 .
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为吨(假设反应过程中硫的损失率为5%,结果保留一位小数).