题目内容
17.已知乙醇的沸点为78℃,能与水以任意比互溶,乙醚的沸点为34.6℃,微溶于水,在饱和Na2CO3溶液中几乎不溶,且乙醚极易燃烧,而乙醇与饱和Na2CO3溶液互溶,今欲在实验室分离乙醚、乙醇.(1)甲和乙两位同学分别设计了甲、乙两套分离乙醚、乙醇的装置(如图所示),从安全和蒸馏效果上分析,其中乙装置更合适,理由是冷却效果好,乙醚远离火源;
(2)若用乙装置,则冷凝管中冷凝水进出的方向为下进上出,若用乙装置分离乙醚、乙醇,则水浴加热用的热水温度范围为40℃-50℃,得到的乙醚中可能还含有少量的乙醇,用碳酸钠溶液除杂,所用的一个主要仪器是漏斗.
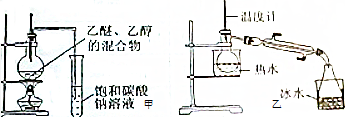
分析 (1)制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近;
(2)冷凝水是下进上出,依据乙醚与乙醇的沸点分析,大于乙醚的沸点温度,要远小于乙醇的沸点,乙醚不溶于碳酸钠据此选择仪器.
解答 解:(1)通过乙醚的沸点(34.6℃)以及易燃烧可以确定制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,
故答案为:乙; 冷却效果好,乙醚远离火源;
(2)要使冷凝效果好,冷凝水应下进上出,乙醚的沸点为34.6℃,乙醇的沸点为:78℃,故选取水浴的温度为40-50℃为好,乙醚不溶于碳酸钠溶液,采用过滤方法分离即可,需要仪器:漏斗,故答案为:下进上出;40-50℃;漏斗.
点评 本题主要考查的是蒸馏与分馏操作等,难度不大,涉及实验操作、混合物的分离等,注意总结.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
7.下列实验方案能达到预定目的是( )
| A. | 将SO2通入石蕊试液中证明SO2有漂白性 | |
| B. | 用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱 | |
| C. | 向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42- | |
| D. | 用干燥的pH试纸可测得新制氯水的pH=2 |
5.过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据四个H2O2参与的化学方程式判断下列说法正确的是( )
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
| A. | 上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是Ag2O>H2O2>K2CrO4 | |
| B. | H2O2既体现氧化性又体现还原性的反应是①③ | |
| C. | H2O2仅体现氧化性的反应是② | |
| D. | H2O2仅体现还原性的反应是③ |
2.下列关于蒸发皿的使用操作正确的是( )
| A. | 用酒精灯火焰的外焰部分直接加热蒸发皿底部 | |
| B. | 蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体直到把液体完全蒸干 | |
| C. | 将热的蒸发皿用手拿离火焰,放在实验台上 | |
| D. | 将灼热的蒸发皿直接放在冰水中冲洗 |
6.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA | |
| B. | 1mol甲基含有的电子数为10NA | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1NA | |
| D. | 标准状况下,4.48L CHCl3中分子数为0.2NA |
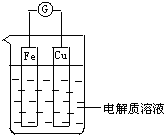 如图所示,组成一个原电池.
如图所示,组成一个原电池. 羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.
羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.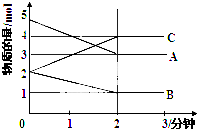 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.