题目内容
16.下列反应既属于化合反应,又属于氧化还原反应的是( )| A. | Fe+2HCl═H2↑+FeCl2 | B. | 2FeCl2+Cl2 ═2FeCl3 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2Fe(OH)3 $\frac{\underline{\;△\;}}{\;}$Fe2O3+3H2O |
分析 氧化还原反应的特征是元素化合价的升降,如有元素化合价的变化,则属于氧化还原反应,结合分解反应和化合反应、置换反应的特点解答该题.
解答 解:A.Fe+2HCl═H2↑+FeCl2属于置换反应,故A错误;
B.2FeCl2+Cl2 ═2FeCl3为化合反应,铁和氯元素化合价发生变化,属于氧化还原反应,故B正确;
C.CaO+H2O═Ca(OH)2没有化合价的变化,不属于氧化还原反应,故C错误;
D.2Fe(OH)3 $\frac{\underline{\;△\;}}{\;}$Fe2O3+3H2O属于分解反应,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,把握物质的反应类型的判断,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
6.在含有XCl2、YCl2、ZCl2和稀盐酸的混合溶液中逐渐加入锌粉,依次置换出的是Z、X、H2而得不到Y,则氧化性最强的离子是( )
| A. | Y2+ | B. | X2+ | C. | Z2+ | D. | H+ |
7.常温下,下列各组离子能大量共存的是( )
| A. | K+,Na+,Br-,Fe3+ | B. | H+,K+,MnO${\;}_{{4}^{\;}}$-,C2O42- | ||
| C. | K+,H+,NO3-,I- | D. | Na+,H+,SO32-,S2+ |
11.下列变化过程中,画横线的元素被还原的是( )
| A. | CO2→CO | B. | FeCl2→FeCl3 | C. | HCl→AgCl | D. | KI→I2 |
5.某实验小组利用如图装置(部分固定装置略)制备氮化钙(Ca3N2,易与水反应),并测定其化学式.
(1)连接好实验装置,检查装置的气密性,方法是关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热,冷却后若末端导管中水柱上升且高度保持不变,说明气密性良好.
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,先熄灭酒精灯,待反应管冷却至室温,停止通N2并关闭活塞K;
④拆除装置,取出产物.
(3)数据记录如下:
①通过以上数据求算化学式CaxN2,x=2.8.
②上述实验产生误差的原因可能是AB (选填编号).
A.N2通入不足,反应器中有O2 B.钙与N2未充分反应 C.产物与空气接触.

(1)连接好实验装置,检查装置的气密性,方法是关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热,冷却后若末端导管中水柱上升且高度保持不变,说明气密性良好.
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,先熄灭酒精灯,待反应管冷却至室温,停止通N2并关闭活塞K;
④拆除装置,取出产物.
(3)数据记录如下:
| 空石英管质量 m0/g | 石英管与钙的质量 m1/g | 石英管与产物的质量 m2/g |
| 14.800 | 15.080 | 15.150 |
②上述实验产生误差的原因可能是AB (选填编号).
A.N2通入不足,反应器中有O2 B.钙与N2未充分反应 C.产物与空气接触.
10.如表陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
| B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
| C | 浓硫酸可干燥NO和SO2 | NO和SO2还原性都弱 |
| D | 浓硫酸有吸水性 | 浓硫酸可用于干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
 氯气的实验室制法
氯气的实验室制法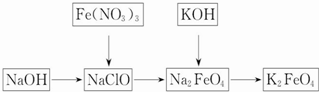
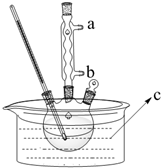 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为: