题目内容
已知可逆反应N2O4(g)?2NO2(g)在873K时,平衡常数K1=1.78×104,转化率为a%,在1273K时,平衡常数K2=2.8×104,转化率为b%,则下列叙述正确的是( )
分析:反应N2O4(g)?2NO2(g),根据题中数据可知,温度升高,平衡常数增大,反应物转化率增大,说明正向反应是吸热反应
A、由于K2>K1,二氧化氮的含量增大,a<b;
B、温度升高,K2>K1,二氧化氮含量升高,反应向着正向移动,根据平衡移动原理判断吸热放热;
C、温度升高,K2>K1,二氧化氮含量升高,反应向着放热吸热方向移动;
D、温度越高,二氧化氮含量越大,气体颜色变深.
A、由于K2>K1,二氧化氮的含量增大,a<b;
B、温度升高,K2>K1,二氧化氮含量升高,反应向着正向移动,根据平衡移动原理判断吸热放热;
C、温度升高,K2>K1,二氧化氮含量升高,反应向着放热吸热方向移动;
D、温度越高,二氧化氮含量越大,气体颜色变深.
解答:解:A、K2>K1,温度升高后,二氧化氮的含量增大,一氧化氮转化率升高,所以a<b,故A错误;
B、由于温度升高,K2>K1,二氧化氮含量升高,反应向着正向移动,正反应方向是吸热反应,△H>0,故B正确;
C、温度升高,K2>K1,二氧化氮含量升高,反应向着正向移动,正反应方向是吸热反应,△H>0,故C错误;
D、由于该反应是吸热反应,温度升高,反应向着正向移动,混合气体的颜色加深,故D错误;
故选B.
B、由于温度升高,K2>K1,二氧化氮含量升高,反应向着正向移动,正反应方向是吸热反应,△H>0,故B正确;
C、温度升高,K2>K1,二氧化氮含量升高,反应向着正向移动,正反应方向是吸热反应,△H>0,故C错误;
D、由于该反应是吸热反应,温度升高,反应向着正向移动,混合气体的颜色加深,故D错误;
故选B.
点评:本题考查了化学平衡的影响因素,化学平衡常数的意义,重点是考查转化率变化和平衡常数变化与反应方向的关系.

练习册系列答案
相关题目
已知可逆反应N2O4(g) 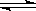 2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
| A.由于K2>K1,所以a>b |
| B.由于K随温度升高而增大,所以此反应的△H>0 |
| C.由于K随温度升高而增大,所以此反应的△H<0 |
| D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅 |
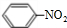
 2NO2(g)
在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g)
在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是