题目内容
9.阅读于谦的诗《石灰吟》,回答问题:千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间.
(1)整首诗所描述的变化共涉及到下列物质:①石灰石(主要成分CaCO3)②CaO ③CO2 ④H2O ⑤Ca(OH)2悬浊液 ⑥CaCO3,其中属于电解质的是②④⑥(填序号)
(2)同学们吃的零食的包装袋中经常有一个小纸带,上面写着“干燥剂”,其主要成分是生石灰(CaO).生石灰属于碱性 氧化物(填“酸性”或“碱性”),用方程式说明你的理由CaO+2HCl=CaCl2+H2O.
(3)某兴趣小组以石灰石、水、氯气为原料制取少量漂白粉.
①写出纯碱溶于水的电离方程式:Na2CO3=2Na++CO32-.
②写出上述制备过程中氯气生成漂白粉的化学方程式:CaCO3=CaO+CO2↑;CaO+H2O=Ca(OH)2;2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
分析 (1)根据水溶液中或熔融状态下能够导电的化合物称为电解质分析;
(2)能和酸反应生成盐和水的氧化物是碱性氧化物,能和碱反应生成盐和水的氧化物是酸性氧化物,根据物质的性质来书写方程式;
(3)①碳酸钠是强电解质,能完全电离出钠离子和碳酸根离子;
②书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据客观事实、遵守质量守恒定律,工业上是采用氯气和石灰乳之间的反应来制取漂白粉,石灰乳可以用氧化钙溶于水的到,氧化钙碳酸钙可以制得氧化钙,氧化钙可以由碳酸钙高温煅烧制得.
解答 解:(1)①石灰石(主要成分CaCO3)是混合物,不是电解质;
②CaO 是熔融状态下能导电的化合物,属于电解质;
③CO2 本身不能发生电离,是非电解质;
④H2O 能发生电离,是电解质;
⑤Ca(OH)2悬浊液是混合物,不是电解质;
⑥CaCO3是熔融状态下能导电的化合物,属于电解质;
故答案为:②④⑥;
(2)氧化钙可以和酸之间反应生成盐和水,属于碱性氧化物,如和盐酸之间的反应为:CaO+2HCl=CaCl2+H2O,故答案为:CaO+2HCl=CaCl2+H2O;
(3)①碳酸钠是强电解质,能完全电离出钠离子和碳酸根离子:Na2CO3=2Na++CO32-,故答案为:Na2CO3=2Na++CO32-;
②以氯气、石灰石、水为原料制取漂白粉的原理:碳酸钙高温煅烧制得氧化钙,CaCO3=CaO+CO2↑,氧化钙溶于水可以和水之间反应生成氢氧化钙,CaO+H2O=Ca(OH)2,氯气和石灰乳之间的反应来制取漂白粉2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:CaCO3=CaO+CO2↑;CaO+H2O=Ca(OH)2;2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查学生物质的分类、电离方程式、化学方程式的书写知识,注意知识的归纳和梳理是解题的关键,难度中等.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案| A. | 实验室常用排饱和食盐水的方法收集氯气 | |
| B. | 工业合成氨控制温度在较高温度(500℃)进行 | |
| C. | 在浓氨水中加入烧碱可用于实验室快速生氨 | |
| D. | 工业上将二氧化硫转化为三氧化硫常通入过量空气 |
| A. | 若再加入X,平衡向正反应方向移动,Z在平衡混合物中的体积分数一定增大 | |
| B. | X的正反应速率是Y的逆反应速率的m/n倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 通入稀有气体使压强增大,平衡将向正反应方向移动 |

| A. | ④⑤①②③ | B. | ①②③④⑤ | C. | ③④①②⑤ | D. | ②①④③⑤ |
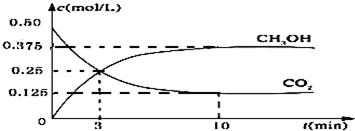
 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液. ;
; .
. ,该反应的反应类型为加成反应.
,该反应的反应类型为加成反应.
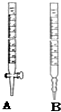 某工厂废水中含游离态氯,通过下列实验测定其浓度
某工厂废水中含游离态氯,通过下列实验测定其浓度