题目内容
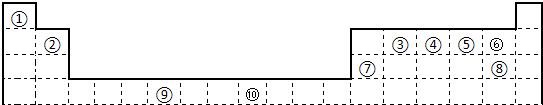
下表为长式周期表的一部分,其中的序号代表对应的元素.
(1)写出⑨原子的外围电子排布式: .
(2)①与③形成的气态化合物是一种水果催熟剂,该化合物中③的杂化方式为: 杂化;⑦与⑧形成化合物的晶体类型是 .
(3)④的第一电离能 (填“>”、“=”或“<”)⑤的第一电离能;①与④形成X,其分子空间构型为 .
(4)实验测定①与⑥形成化合物的相对分子质量时,实验测得值一般高于理论值,试从物质结构角度解释原因: .
(5)将X通入含有⑩的蓝色硫酸盐溶液中,首先形成难溶物,继续通入X,难溶物溶解得到深蓝色的透明溶液.试写出该过程的有关离子方程式: 、 .

(1)写出⑨原子的外围电子排布式:
(2)①与③形成的气态化合物是一种水果催熟剂,该化合物中③的杂化方式为:
(3)④的第一电离能
(4)实验测定①与⑥形成化合物的相对分子质量时,实验测得值一般高于理论值,试从物质结构角度解释原因:
(5)将X通入含有⑩的蓝色硫酸盐溶液中,首先形成难溶物,继续通入X,难溶物溶解得到深蓝色的透明溶液.试写出该过程的有关离子方程式:
分析:由元素在周期表中的位置可知,①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Cr、⑩为Cu,
(1)为Cr元素,原子核外电子数为24,结合洪特规则特例书写;
(2))①与③形成的气态化合物是一种水果催熟剂,该化合物为C2H4,分子中C原子成3个σ键,不含孤对电子,杂化轨道数为3,据此确定C原子的杂化方式;
⑦与⑧形成化合物氯化镁,为活泼金属与活泼非金属元素形成的化合物,属于离子化合物;
(3)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于氧元素;①与④形成X为NH3,分子空间构型为三角锥形;
(4)HF分子之间形成氢键,缔合形成(HF)n;
(5)铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液.
(1)为Cr元素,原子核外电子数为24,结合洪特规则特例书写;
(2))①与③形成的气态化合物是一种水果催熟剂,该化合物为C2H4,分子中C原子成3个σ键,不含孤对电子,杂化轨道数为3,据此确定C原子的杂化方式;
⑦与⑧形成化合物氯化镁,为活泼金属与活泼非金属元素形成的化合物,属于离子化合物;
(3)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于氧元素;①与④形成X为NH3,分子空间构型为三角锥形;
(4)HF分子之间形成氢键,缔合形成(HF)n;
(5)铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液.
解答:解:由元素在周期表中的位置可知,①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Cr、⑩为Cu,
(1)为Cr元素,原子核外电子数为24,由洪特规则特例可知,其外围电子排布式为:3d54s1,
故答案为:3d54s1;
(2))①与③形成的气态化合物是一种水果催熟剂,该化合物为C2H4,分子中C原子成3个σ键,不含孤对电子,杂化轨道数为3,故C原子的杂化方式为sp2,⑦与⑧形成化合物氯化镁,为活泼金属与活泼非金属元素形成的化合物,属于离子化合物,
故答案为:sp2;离子化合物;
(3)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于氧元素;①与④形成X为NH3,分子空间构型为三角锥形
故答案为:>;三角锥形;
(4)HF分子之间形成氢键,缔合形成(HF)n,故测定HF的相对分子质量偏大,
故答案为:HF分子之间形成氢键,缔合形成(HF)n;
(5)铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-.
(1)为Cr元素,原子核外电子数为24,由洪特规则特例可知,其外围电子排布式为:3d54s1,
故答案为:3d54s1;
(2))①与③形成的气态化合物是一种水果催熟剂,该化合物为C2H4,分子中C原子成3个σ键,不含孤对电子,杂化轨道数为3,故C原子的杂化方式为sp2,⑦与⑧形成化合物氯化镁,为活泼金属与活泼非金属元素形成的化合物,属于离子化合物,
故答案为:sp2;离子化合物;
(3)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于氧元素;①与④形成X为NH3,分子空间构型为三角锥形
故答案为:>;三角锥形;
(4)HF分子之间形成氢键,缔合形成(HF)n,故测定HF的相对分子质量偏大,
故答案为:HF分子之间形成氢键,缔合形成(HF)n;
(5)铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-.
点评:本题考查结构性质位置关系的综合应用,涉及核外电子排布、电离能、杂化轨道、分子结构、氢键、配合物等,(1)为易错点,学生容易忽略洪特规则特例,注意氢键对物质性质的影响.

练习册系列答案
相关题目