题目内容
某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
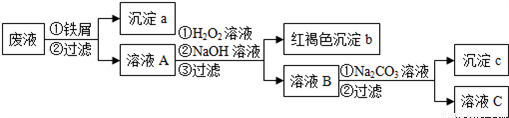
请回答:
(1)沉淀a中含有的单质是_________;
(2)沉淀b的化学式是__________;
(3)沉淀c的化学式是__________;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_______________。
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g) CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g) 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g) CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g) 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。

(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5,  ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。



 CH3CH2COOH的原子利用率为100%
CH3CH2COOH的原子利用率为100%
