题目内容
【题目】下列关于氧的单质O2和O3的说法中,正确的是
A. O2和O3互为同位素
B. O2和O3的相互转化是物理变化
C. 等质量的O2和O3含有的原子数相同
D. 等体积的O2和O3含有的分子数相同
【答案】C
【解析】A.质子数相同,而中子数不同的原子互为同位素,O2和O3是两种单质互为同素异形体,故A错误;B.氧气与臭氧是不同的物质,其转化属于化学变化,故B错误;D.均为氧原子构成的分子微粒,相同质量的O2和O3含有的氧原子数相等,故C正确;D.只有在相同的温度与压强下,气体的摩尔体积才相等,等体积的O2和O3含有的分子数才相同,故D错误;答案为C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下 转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
① 请结合上表数据,写出NO与CO反应的化学方程式________________________。
② 根据表中数据判断,温度T1和T2的关系是(填序号)_________________________。
A.T1>T2 B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH= - 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为_________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
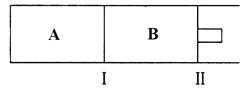
当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为_______________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将_______________(填“正向”、“逆向”或“不”)移动。
【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
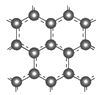
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
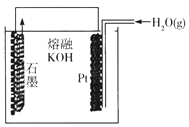
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。