题目内容
神舟七号载人航天飞船成功发射升空,发射飞船用“长征二号F型”运载火箭,该火箭用肼(N2H4)作燃料,N2H4与NH3有相似的化学性质.
(1)写出肼与盐酸反应的离子方程式 .
(2)用拉席希法制备肼,是将NaClO和NH3按物质的量之比为1:2反应生成肼,试写出该反应的化学方程式 ,该反应中 是氧化剂.
(3)发射火箭时若以肼(N2H4)为燃料,一氧化二氮作氧化剂,两者反应生成氮气和气态水.已知4g N2H4(g)在上述反应中放出71kJ的热量,写出热化学方程式 .
(4)为使宇航员有良好的生存环境,宇宙飞船中装有盛Na2O2颗粒的供氧装置,如用KO2(超氧化钾)代替Na2O2,也能达到同样的目的.写出KO2与CO2反应的化学方程式 .
(1)写出肼与盐酸反应的离子方程式
(2)用拉席希法制备肼,是将NaClO和NH3按物质的量之比为1:2反应生成肼,试写出该反应的化学方程式
(3)发射火箭时若以肼(N2H4)为燃料,一氧化二氮作氧化剂,两者反应生成氮气和气态水.已知4g N2H4(g)在上述反应中放出71kJ的热量,写出热化学方程式
(4)为使宇航员有良好的生存环境,宇宙飞船中装有盛Na2O2颗粒的供氧装置,如用KO2(超氧化钾)代替Na2O2,也能达到同样的目的.写出KO2与CO2反应的化学方程式
考点:氧化还原反应,离子方程式的书写,热化学方程式
专题:氧化还原反应专题,化学反应中的能量变化
分析:(1)肼与盐酸反应生成N2H62+;
(2)NaClO和NH3按物质的量之比为1:2,则NH3和NaClO的计量数2:1,然后根据原子守恒分析;
(3)由n=
计算物质的量,物质的量与放出的热量成正比,以此书写热化学反应方程式;
(4)KO2与CO2反应生成碳酸钾和氧气.
(2)NaClO和NH3按物质的量之比为1:2,则NH3和NaClO的计量数2:1,然后根据原子守恒分析;
(3)由n=
| m |
| M |
(4)KO2与CO2反应生成碳酸钾和氧气.
解答:
解:(1)肼与盐酸反应生成N2H62+,离子反应为N2H4+2H+=N2H62+,故答案为:N2H4+2H+=N2H62+;
(2)NaClO和NH3按物质的量之比为1:2,则NH3和NaClO的计量数2:1,结合原子守恒可知反应为2NH3+NaClO=N2H4+NaCl+H2O,Cl元素的化合价降低,则NaClO为氧化剂,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;NaClO;
(3)由n=
=
=
mol,与二氧化氮反应生成氮气与气态水放出71kJkJ的热量,物质的量与放出的热量成正比,则2mol气体肼完全燃烧生成气态水放出的热量为1136kJ,所以该反应的热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ?mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+2H2O (g)△H=-1136kJ/mol;
(4)KO2与CO2反应生成碳酸钾和氧气,反应为4KO2+2CO2=2K2CO3+3O2,故答案为:4KO2+2CO2=2K2CO3+3O2.
(2)NaClO和NH3按物质的量之比为1:2,则NH3和NaClO的计量数2:1,结合原子守恒可知反应为2NH3+NaClO=N2H4+NaCl+H2O,Cl元素的化合价降低,则NaClO为氧化剂,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;NaClO;
(3)由n=
| m |
| M |
| 4g |
| 32g/mol |
| 1 |
| 8 |
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+2H2O (g)△H=-1136kJ/mol;
(4)KO2与CO2反应生成碳酸钾和氧气,反应为4KO2+2CO2=2K2CO3+3O2,故答案为:4KO2+2CO2=2K2CO3+3O2.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重离子反应、化学反应、热化学反应书写的考查,综合性较强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论错误的是( )
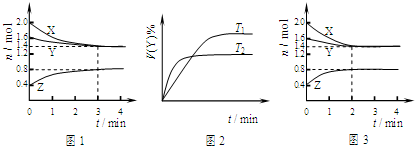

| A、发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、保持其他条件不变,升高温度,平衡常数K减小 |
| C、反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol?L-1?min-1 |
| D、若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
下列有关硅及其化合物的说法错误的是( )
| A、硅的导电性能介于导体和绝缘体之间,是良好的半导体材料 |
| B、二氧化硅属于酸性氧化物,不能与任何酸反应 |
| C、硅酸可通过可溶性硅酸盐与其他酸反应制得,硅酸酸性比碳酸弱 |
| D、硅酸钠的水溶液俗称水玻璃,可作木材防火剂 |
按如图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中错误的是( )


| A、甲池中,Cu极上有气泡放出 |
| B、发现a点附近显红色 |
| C、电子走向Zn→a→b→C2 |
| D、乙池溶液的pH减小 |
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题. 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.