题目内容
某温度下,在体积为2L的密闭容器中,充人1mol A和a mol B气体,发生如下反应:A(g)+B(g)?2C(g).5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系曲线如图所示.下列叙述正确的是( )

| A.0~5 min,C物质的平均反应速率为0.04 mol/(L?min) |
| B.图中T1时的正反应速率等于T2时的正反应速率 |
| C.T2时的平衡常数大于T3时的平衡常数 |
| D.图中T2时,若只增大压强,则正、逆反应速率不改变 |

曲线上最高点为平衡点,最高点之前未达平衡,反应向正反应进行,最高点之后,各点为平衡点,升高温度C的含量降低,平衡向逆反应,故正反应为放热反应,
A.5min后反应达到平衡时n(A)为0.4mol,则△n(A)=1mol-0.4mol=0.6mol,故△n(C)=2△n(A)=1.2mol,故v(C)=
=0.12mol/(L?min),故A错误;
B.T1时未到达平衡状态,T2时处于平衡状态,温度越高反应速率越快,T1时的正反应速率小于T2时的正反应速率,故B错误;
C.升高温度平衡向逆反应移动,平衡常数降低,故T2时的平衡常数大于T3时的平衡常数,故C正确;
D.反应前后气体的物质的量不变,增大压强,正、逆反应速率同等程度增大,故D错误;
故选C.
A.5min后反应达到平衡时n(A)为0.4mol,则△n(A)=1mol-0.4mol=0.6mol,故△n(C)=2△n(A)=1.2mol,故v(C)=
| ||
| 5min |
B.T1时未到达平衡状态,T2时处于平衡状态,温度越高反应速率越快,T1时的正反应速率小于T2时的正反应速率,故B错误;
C.升高温度平衡向逆反应移动,平衡常数降低,故T2时的平衡常数大于T3时的平衡常数,故C正确;
D.反应前后气体的物质的量不变,增大压强,正、逆反应速率同等程度增大,故D错误;
故选C.

练习册系列答案
相关题目
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫。
在催化剂作用下,CO2和H2可以制取甲醇和乙醇。如:2CO2(g)+6H2(g)
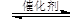 CH3CH2OH(g)+3H2O(g)
。
CH3CH2OH(g)+3H2O(g)
。
(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表。分析表中数据回答下列问题:
|
|
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2.0 |
60 |
43 |
28 |
15 |
|
3.0 |
83 |
62 |
37 |
22 |
温度升高,平衡常数K值将 (填“增大”、“减小”、或“不变”)。提高氢碳比[n(H2)/n(CO2)], 平衡常数K值将 (填“增大”、“减小”、或“不变”)。
在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到800K D.使用合适的催化剂
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
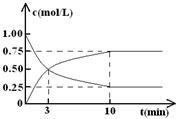
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= ;
氢气的平衡浓度为 mol/L。
 如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.
