题目内容
已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是
A.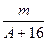 (A-n+8)mol (A-n+8)mol | B.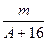 (A-n+10)mol (A-n+10)mol |
| C.(A-n+2)mol | D.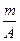 (A-n+6)mol (A-n+6)mol |
A
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
题目内容
A.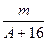 (A-n+8)mol (A-n+8)mol | B.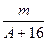 (A-n+10)mol (A-n+10)mol |
| C.(A-n+2)mol | D.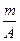 (A-n+6)mol (A-n+6)mol |

 名校课堂系列答案
名校课堂系列答案