题目内容
【题目】下表列出了10种元素在元素周期表中的位置:
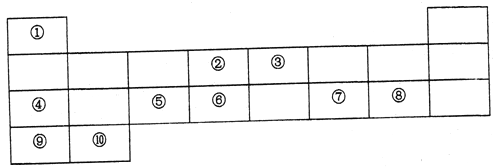
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第_____周期,第______族。
(2)上述10种元素中,金属性最强的元素的符号为_________,最高价氧化物对应水化物中,酸性最强的物质的分子式为______,其中和Ar核外电子排布相同的离子的半径由大到小的顺序是为__________(用离子符号表示)。
(3)元素③的最高价氢化物的电子式为________,元素②和元素⑥的最简单氢化物中,稳定性较强的物质的结构式为______。用电子式表示⑦和⑨形成化合物的过程________。
(4)④在空气中燃烧的产物中所含化学键有________。
A.离子键 B.极性键 C.非极性键
(5)元素④、⑤、⑦的最高价氧化物对应水化物两两之间发生反应的离子方程式分别为____、_______、________。⑧的单质与⑩的最高价氧化物对应水化物反应的化学方程式为________。
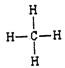
【答案】 二 IVA K HClO4 S2->Cl->K+>Ca2+ ![]()
![]() AC Al(OH)3+3H+=Al3++3H2O H++OH-=H2O Al(OH)3+OH-=AlO2-+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
AC Al(OH)3+3H+=Al3++3H2O H++OH-=H2O Al(OH)3+OH-=AlO2-+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】根据元素在周期表中的位置,首先判断出元素种类。然后依据元素周期律和相关物质的性质解答。
根据10种元素在元素周期表中的位置可判断它们分别是H、C、N、Na、Al、Si、S、Cl、K、Ca,则
(1)碳元素在元素周期表中处于第二周期、第 IVA族。(2)同周期自左向右金属性逐渐减弱,同主族自上而下金属性逐渐增强,则上述10种元素中,金属性最强的元素的符号为K;氯元素的非金属性最强,则最高价氧化物对应水化物中,酸性最强的物质的分子式为HClO4;核外电子排布相同的离子,其离子半径随原子序数的增大而减小,因此其中和Ar核外电子排布相同的离子的半径由大到小的顺序是为S2->Cl->K+>Ca2+。(3)元素③的最高价氢化物是氨气,含有共价键,电子式为![]() ;同主族自上而下非金属性逐渐减弱,元素②和元素⑥的最简单氢化物中,稳定性较强的物质是甲烷,结构式为
;同主族自上而下非金属性逐渐减弱,元素②和元素⑥的最简单氢化物中,稳定性较强的物质是甲烷,结构式为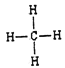 。⑦和⑨形成化合物是硫化钾,含有离子键,其形成的过程可表示为
。⑦和⑨形成化合物是硫化钾,含有离子键,其形成的过程可表示为![]() 。(4)钠在空气中燃烧的产物是过氧化钠,其中所含化学键有离子键、非极性键,答案选AC。(5)元素④、⑤、⑦的最高价氧化物对应水化物分别是氢氧化钠、氢氧化铝和硫酸,两两之间发生反应的离子方程式分别为Al(OH)3+3H+=Al3++3H2O、H++OH-=H2O、Al(OH)3+OH-=AlO2-+2H2O。氯气与氢氧化钙溶液反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
。(4)钠在空气中燃烧的产物是过氧化钠,其中所含化学键有离子键、非极性键,答案选AC。(5)元素④、⑤、⑦的最高价氧化物对应水化物分别是氢氧化钠、氢氧化铝和硫酸,两两之间发生反应的离子方程式分别为Al(OH)3+3H+=Al3++3H2O、H++OH-=H2O、Al(OH)3+OH-=AlO2-+2H2O。氯气与氢氧化钙溶液反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案