题目内容
在2SO2+O2![]() 2SO3反应中,SO2的起始浓度为2mol×L-1,O2的浓度为lmol×L-1。经过2min后测得SO2的浓度为0.8mol×L-1。则此O2的浓度是多少?若以SO2的浓度变化来表示这段时间的反应速率应是多少?
2SO3反应中,SO2的起始浓度为2mol×L-1,O2的浓度为lmol×L-1。经过2min后测得SO2的浓度为0.8mol×L-1。则此O2的浓度是多少?若以SO2的浓度变化来表示这段时间的反应速率应是多少?
答案:
解析:
解析:
解:设反应中消耗SO2和O2的物质的量关系为2∶1,此时消耗的SO2和O2的浓度之比也为2∶1。起始SO2的浓度为2mol×L-1,2min后变为0.8mol×L-1,减少1.2mol×L-1,则O2的浓度减少0.6mol×L-1。 2SO2
+ O2 起始: 2mol×L-1 1mol×L-1 2min后:0.8mol×L-1 减少:1.2mol×L-1 0.6mol×L-1 2min后O2的浓度:(1-0.6)mol×L-1=0.4mol×L-1 2min内v(SO
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
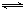 2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是( )
2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是( ) 2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则
2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则 =_____________________,各物质所表示的反应速率的最简整数比
=_____________________,各物质所表示的反应速率的最简整数比 :
: =_________
=_________ 2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则
2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则 =_____________________,各物质所表示的反应速率的最简整数比
=_____________________,各物质所表示的反应速率的最简整数比 :
: =_________
=_________