题目内容
【题目】2019年获诺贝尔化学奖的是约翰·班尼斯特·古迪纳夫(John B.Goodenough)、迈克尔·斯坦利·威廷汉(M.Stanley Whittlingham)和吉野彰( Akira Yoshino)三位科学家,他们在锂离子电池发展上做出了突出贡献。锂离子电池是将层状石墨加导电剂及黏合剂涂在铜箔基带上,将钴酸锂(LiCoO2)涂在铝箔上制作而成,利用锂离子在两极上的嵌入和脱嵌进行充、放电,其原理如图所示。下列说法错误的是

LiCoO2+6C=Li1-xCoO2+LixC6
A.石墨加导电剂及黏合剂涂在铜箔基带上作锂离子电池的负极
B.充电时Li+从石墨层状结构中脱嵌,进入电解质
C.放电时的正极反应为Li1-xCoO2+xLi++xe-=LiCoO2
D.锂离子电池常用非水液态有机电解质作电解液
【答案】B
【解析】
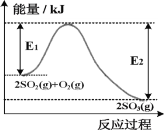
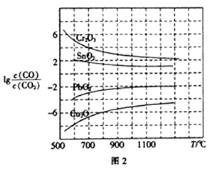
从图中可以看出,左侧为铝箔,右侧是石墨,放电过程中锂离子从石墨电极上脱嵌,铝箔电极上嵌入,充电过程中锂离子从铝箔电极上脱嵌,在石墨电极上嵌入。放电的方程式为LixC6+Li1-xCoO2=LiCoO2+6C,反之为充电的方程式。
A.从图中可以看出,右侧石墨电极中锂离子脱嵌,LixC6失去电子,做负极,A正确;
B.充电时锂离子从铝箔电极上脱嵌进入电解质,B错误;
C.放电时,正极为电解质中的Li+得电子与正极上的Li1-xCoO2结合生成LiCoO2,电极方程式为Li1-xCoO2+xLi++xe-=LiCoO2,C正确;
D.锂是活泼的金属,锂离子电池常用非水溶剂电解质作为电解液,当用水溶剂做电解质时,充电过程中易生成气体,影响使用安全和使用寿命,D正确;
故选B。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目