题目内容
【题目】甲醇燃料电池的总反应为:2CH3OH +3O2= 2CO2 ↑+ 4H2O,下图是该电池的示意图。下列说法正确的是
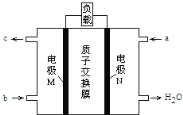
A.a 是氧气,b 是甲醇
B.质子从 N 电极区穿过质子交换膜移向 M 电极区
C.正极反应为:O2 +2H2O + 4e- = 4 OH-
D.当电路中有 3 mole- 转移时,电池中n(H+)变化为 0
【答案】AD
【解析】
试题分析:燃料电池中,负极上是燃料失电子发生氧化反应,正极上是氧化剂得电子发生还原反应,通过图片知,电极N有水生成,说明a处通入氧气,氧气在正极得电子与氢离子结合生成水,正极反应为O2 +4H+ + 4e- =2H2O,则氢离子是从左向右移动,说明b处通入的是甲醇,甲醇反应生成氢离子,氢离子从M电极区穿过质子交换膜移向N电极区,根据化学反应2CH3OH +3O2= 2CO2 ↑+ 4H2O,该反应没有氢离子的消耗和生成,所以电池中n(H+)变化为 0,AD正确;答案选AD。

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉溶液后溶液变蓝色 | 氧化性:Cl2>I2 |
B. | 将可调节高度的铜丝伸入稀硝酸中 | 溶液变蓝 | 铜与稀硝酸发生置换反应 |
C. | 向溶液X中滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
D. | 常温下将铝片放入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |


