题目内容
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
| A、Na和O2 |
| B、FeCl3溶液和Mg |
| C、Fe和Cl2 |
| D、AlCl3溶液和NaOH |
考点:钠的化学性质,镁、铝的重要化合物,铁的化学性质,铁的氧化物和氢氧化物
专题:
分析:A、根据Na和O2反应的条件的不同,生成物也不同;
B、根据Mg少量将三价铁还原成二价铁,过量将三价铁还原成铁单质;
C、根据氯气具有强氧化性,所以铁和氯气反应只能生成氯化铁;
D、氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
B、根据Mg少量将三价铁还原成二价铁,过量将三价铁还原成铁单质;
C、根据氯气具有强氧化性,所以铁和氯气反应只能生成氯化铁;
D、氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
解答:
解:A、Na和O2在常温下反应生成氧化钠,Na和O2在加热条件下反应生成氧化钠,反应条件改变,会引起产物的种类改变,故A不符合;
B、Mg少量将三价铁还原成二价铁,过量将三价铁还原成铁单质,所以反应物用量改变,会引起产物的种类改变,故B不符合;
C、氯气具有强氧化性,所以铁和氯气反应只能生成氯化铁,生成物不随反应条件或反应物的用量变化而变化,故C符合;
D、氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,故D不符合;
故选C.
B、Mg少量将三价铁还原成二价铁,过量将三价铁还原成铁单质,所以反应物用量改变,会引起产物的种类改变,故B不符合;
C、氯气具有强氧化性,所以铁和氯气反应只能生成氯化铁,生成物不随反应条件或反应物的用量变化而变化,故C符合;
D、氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,故D不符合;
故选C.
点评:本题是对物质之间反应物量的不同导致的结果不同的考查,解题的关键是掌握具体的反应产物的不同,属于物质之间反应的探讨,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将2.24L(标况下)的CO2和CO混合气体通有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后剩余0.28L(标况下)的某气体,则原混合气体中CO2和CO的体积比为( )
| A、1:1 | B、1:3 |
| C、2:1 | D、1:4 |
下列说法或做法正确的是( )
| A、硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、铝比铁活泼,所以铝比铁更容易被腐蚀 |
| D、赏心悦目的雕花玻璃是用烧碱对玻璃进行刻蚀而制成的 |
下列有关铁及其化合物的描述中不正确的是( )
| A、Fe3+离子只具有氧化性,Fe只具有还原性 |
| B、除去FeCl2溶液中混有的少量FeCl3,最好的方法是通入氯气 |
| C、Fe2+的水溶液为浅绿色,Fe2+既有氧化性又有还原性 |
| D、Fe3+的水溶液为棕黄色,可用含SCN-的溶液检验 |
工业上用制盐剩下的苦卤(主要成分是MgCl2)来制取硝酸镁,下列方案中合理可行的是( )
| A、向苦卤中加入AgNO3,滤出沉淀,将溶液蒸干 |
| B、将苦卤蒸发浓缩,再加入AgNO3,把得到的溶液蒸发结晶 |
| C、给苦卤中加入熟石灰,分离出沉淀,用稀硝酸将沉淀溶解,再将溶液浓缩结晶 |
| D、将苦卤浓缩结晶,再进行电解,得到金属镁,用镁和HNO3反应 |
下列物质不能通过化合反应直接制得的是( )
| A、NaCl |
| B、Al(OH)3 |
| C、FeCl2 |
| D、CO |
下列说法正确的是( )
| A、将蔗糖溶于水不能导电且其熔融状态也不能导电,故蔗糖不是电解质 |
| B、CO2溶于水得到的溶液能导电,所以CO2是电解质 |
| C、金属能导电,所以金属是电解质 |
| D、固态的NaCl不导电,所以 NaCl不是电解质 |
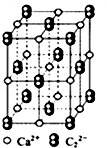 CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )| A、6.4克CaC2晶体中含阴离子0.2 mol |
| B、该晶体中的阴离子与N2是互为等电子体 |
| C、1个Ca2+周围距离最近且等距离的C22-数目为6 |
| D、与每个Ca2+距离相等且最近的Ca2+共有12个 |