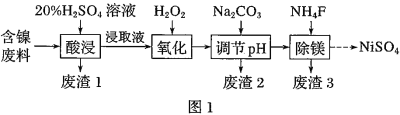
题目内容
【题目】以冶铝的废弃物铝灰为原料制取超细![]() 氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为
氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() ,其制备实验流程如图1:
,其制备实验流程如图1:
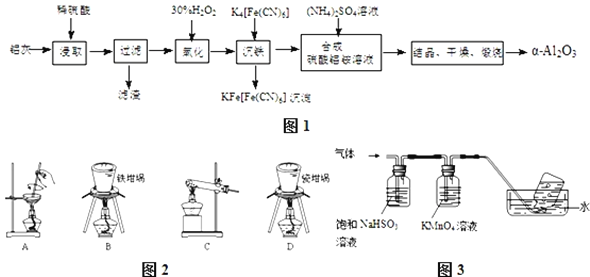
![]() 铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
![]() 用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______
用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______ ![]() 填选项编号
填选项编号![]() .
.
![]() 在实验流程中,加
在实验流程中,加![]() 的
的![]() 溶液发生的离子反应方程式为 ______ .
溶液发生的离子反应方程式为 ______ .
![]() 验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
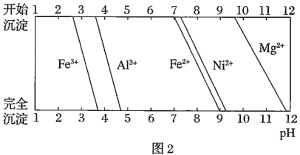
![]() 若用调节pH溶液“沉铁”,则得到
若用调节pH溶液“沉铁”,则得到![]() ,已知:
,已知:![]() 时,
时,![]() ,则该温度下反应
,则该温度下反应![]() 的平衡常数为 ______ .
的平衡常数为 ______ .
![]() 煅烧硫酸铝铵晶体,发生的主要反应为:
煅烧硫酸铝铵晶体,发生的主要反应为:![]()
![]()
![]() ,将产生的气体通过图3所示的装置.
,将产生的气体通过图3所示的装置.
①集气瓶中收集到的气体是 ______ ![]() 填化学式
填化学式![]() .
.
②![]() 溶液褪色,发生的离子反应方程式为 ______ .
溶液褪色,发生的离子反应方程式为 ______ .
【答案】![]() B
B ![]() 静置,溶液澄清后,继续向上层清液中滴加
静置,溶液澄清后,继续向上层清液中滴加![]() 溶液,若无现象,则溶液中不含有铁元素,反之,则有
溶液,若无现象,则溶液中不含有铁元素,反之,则有 ![]()
![]()
![]()
【解析】
铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() 加稀硫酸,
加稀硫酸,![]() 、FeO、
、FeO、![]() 转化为离子,
转化为离子,![]() 不溶于硫酸,过滤,滤液中含有
不溶于硫酸,过滤,滤液中含有![]() 、
、![]() 、
、![]() ,加双氧水,
,加双氧水,![]() 被氧化为
被氧化为![]() ,加入
,加入![]() 转化为沉淀,过滤,在滤液中加入硫酸铵,生成
转化为沉淀,过滤,在滤液中加入硫酸铵,生成![]() ,结晶、干燥、煅烧得到
,结晶、干燥、煅烧得到![]() ;
;
(1)![]() 与硫酸反应生成硫酸铝和水;
与硫酸反应生成硫酸铝和水;
(2)蒸发皿不能用来加热固体,瓷坩埚含有二氧化硅和氢氧化钠反应;
(3)加![]() 的
的![]() 溶液
溶液![]() 被氧化为
被氧化为![]() ;
;
(4)三价铁离子遇到![]() 反应生成沉淀,据此设计实验检验是否含铁离子;
反应生成沉淀,据此设计实验检验是否含铁离子;
(5)依据平衡常数的概念结合反应写出计算式计算平衡浓度解答;
(6)①![]() 分解生成的气体
分解生成的气体![]() 和
和![]() 被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收;
被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收;
②![]() 与二氧化硫反应生成硫酸根离子和锰离子。
与二氧化硫反应生成硫酸根离子和锰离子。
铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() 加稀硫酸,
加稀硫酸,![]() 、FeO、
、FeO、![]() 转化为离子,
转化为离子,![]() 不溶于硫酸,过滤,滤液中含有
不溶于硫酸,过滤,滤液中含有![]() 、
、![]() 、
、![]() ,加双氧水,
,加双氧水,![]() 被氧化为
被氧化为![]() ,加入
,加入![]() 转化为沉淀,过滤,在滤液中加入硫酸铵,生成
转化为沉淀,过滤,在滤液中加入硫酸铵,生成![]() ,结晶、干燥、煅烧得到
,结晶、干燥、煅烧得到![]() ;
;
(1)![]() 与硫酸反应生成硫酸铝和水,其反应的方程式为:
与硫酸反应生成硫酸铝和水,其反应的方程式为:![]() ;
;
(2)A.蒸发皿不能用来加热固体,故A不符合;
B.铁坩埚可以熔融二氧化硅和氢氧化钠,故B符合;
C.玻璃中含二氧化硅和氢氧化钠反应,故C不符合;
D.瓷坩埚含有二氧化硅和氢氧化钠反应,故D不符合;
(3)滤液中含有![]() 、
、![]() 、
、![]() ,加
,加![]() 的
的![]() 溶液
溶液![]() 被氧化为
被氧化为![]() ,其反应的离子方程式为:
,其反应的离子方程式为:![]() ;
;
(4)铁离子和铁氰化钾反应产生沉淀,其检验方法是:静置,溶液澄清后,继续向上层清液中滴加![]() 溶液,若无现象,则溶液中不含有铁元素,反之,则有;
溶液,若无现象,则溶液中不含有铁元素,反之,则有;
(5)![]() ,
, ,反应
,反应![]() 的平衡常数
的平衡常数 ;
;
(6)①![]() 分解生成的气体
分解生成的气体![]() 和
和![]() 被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是
被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是![]() ;
;
②酸性条件下,![]() 与二氧化硫反应生成硫酸根离子和锰离子,其反应的离子方程式为:
与二氧化硫反应生成硫酸根离子和锰离子,其反应的离子方程式为:![]() 。
。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案