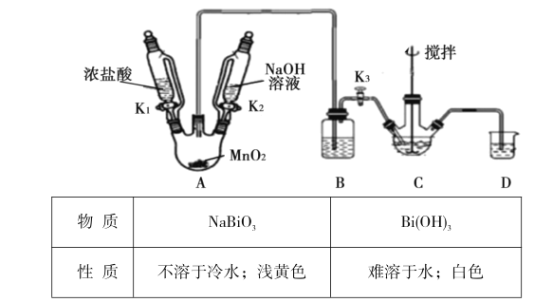
题目内容
【题目】砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________,AsH3的电子式_________。
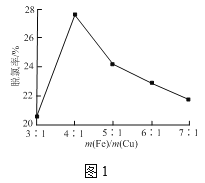
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________(填化学式)。

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) ![]() 2As(g) +3CO(g)
2As(g) +3CO(g) ![]() =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s) ![]()
![]() As4(g) +3CO(g)
As4(g) +3CO(g) ![]() =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) ![]() 4As(g)
4As(g) ![]()
① ![]() =_________kJ ·mol-1 (用含a,b的代数式表示)。
=_________kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
反应II | 反应III | ||
活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:![]() (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)![]()
![]() (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
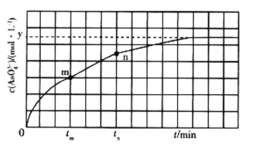
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v(![]() )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(![]() )/c(
)/c(![]() )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正(![]() )_______ (填“大于”“小于”或“等于”)v逆(
)_______ (填“大于”“小于”或“等于”)v逆( ![]() )。
)。
③tm min时v逆( ![]() ) _______ (填“大于”“小于”或“等于”)tn时v逆(
) _______ (填“大于”“小于”或“等于”)tn时v逆( ![]() ),理由是___________________。
),理由是___________________。
【答案】第四周期第ⅴA族 ![]() SO2 2a-2b 优于 bd > < tm时生成物浓度较低
SO2 2a-2b 优于 bd > < tm时生成物浓度较低
【解析】
(1)As是33号元素,根据其核外电子排布规律确定元素周期表中的位置;AsH3是共价化合物,据此写出电子式;
(2)根据题给信息,结合氧化还原反应规律确定反应中消耗氧气的量,根据原子守恒确定产物的化学式;
(3)①根据盖斯定律进行计算;
②反应的活化能越小,反应速率越快,根据表格数据和题给信息(反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少),相对于催化剂Y,使用催化剂X时,反应Ⅱ(生成As4)的活化能更大,生成As4的反应速率小,从而降低副反应Ⅱ的进行程度,并且反应Ⅲ活化能相对较小,消耗As的反应速率大,使As4尽可能转化为As;
(4)①根据反应达到平衡时,正逆反应速率相等,各组分的浓度保持不变进行平衡状态的分析;
②结合图像分析,反应从正反应方向开始进行,tm时反应继续正向进行;
③结合图像分析,tm时AsO43-的浓度比tn时小,所以逆反应速率v(tm)<v(tn)。
(1)As是33号元素,在元素周期表中的位置是第四周期第ⅤA族,AsH3是共价化合物,电子式为![]() ,故本题答案为:第四周期第ⅴA族;
,故本题答案为:第四周期第ⅴA族;![]() ;
;
(2)若该反应中1mol As4S4参加反应时,转移28mole-,则消耗了7mol氧气,则化学方程式为:As4S4+7O2=2As2O3+4SO2,物质a为SO2,本题答案为:SO2;
(3)①反应 I .As2O3(g) +3C(s)![]() 2As(g) +3CO(g)
2As(g) +3CO(g) ![]() =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)![]()
![]() As4(g) +3CO(g)
As4(g) +3CO(g)![]() =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g)![]() 4As(g)
4As(g)![]()
由盖斯定律有:反应III=反应Ⅰ×2-反应Ⅱ×2,得到As4(g)![]() 4As(g)
4As(g)![]() =(2a-2b)kJ ·mol-1,故答案为2a-2b;
=(2a-2b)kJ ·mol-1,故答案为2a-2b;
②反应的活化能越小,反应速率越快,根据表格数据和题给信息(反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少),相对于催化剂Y,使用催化剂X时,反应Ⅱ(生成As4)的活化能更大,生成As4的反应速率小,从而降低副反应Ⅱ的进行程度,并且反应Ⅲ活化能相对较小,消耗As的反应速率大,使As4尽可能转化为As,所以催化剂X优于催化剂Y,本题答案为:优于;
(4)①a.题中未指出是正反应速率还是逆反应速率,不能判断,a项错误;
b.溶液的c(OH-)不变,则pH也保持不变,所以体系中各组分的浓度均不再变化,反应处于平衡状态,b项正确;
c.由题图知,平衡时c(I-)=2c(AsO43-)=2y mol/L所以c(I-)=y mol/L时反应不是平衡状态,c项错误;
d.由于As元素的总量一定,所以c(![]() )/c(
)/c(![]() )不再发生变化,c(
)不再发生变化,c(![]() )与c(
)与c(![]() )均保持不变,反应处于平衡状态,d项正确;
)均保持不变,反应处于平衡状态,d项正确;
e.由离子方程式可知,钠离子不参与反应,故钠离子的浓度一直不变,当c(Na+)=5xmol· L-1,不能判断反应是否平衡,e项错误;
故选bd。
②反应从正反应方向开始进行,tm时反应继续正向进行,故v(正)>v(逆),本题答案为:>;
③tm时AsO43-的浓度比tn时小,所以逆反应速率v(tm)<v(tn),故本题答案为:<;tm时生成物浓度较低。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案