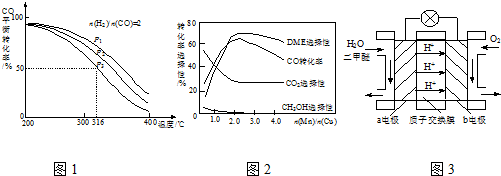
题目内容
14.下列有关性质的比较中,正确的是( )| A. | 还原性Cl->Fe2+ | B. | 熔点Al2O3>Al | ||
| C. | 稳定性Fe(OH)2>Fe(OH)3 | D. | 碱性Al(OH)3>NH3•H2O |
分析 A、根据反应2Fe2++Cl2=2Fe3++2Cl-来分析;
B、一般物质的熔点为原子晶体>离子晶体>金属晶体>分子晶体;
C、Fe(OH)2有很强的还原性,极易被氧化;
D、Al(OH)3为沉淀.
解答 解:A、根据反应2Fe2++Cl2=2Fe3++2Cl-可知,Fe2+是还原剂,而Cl-是还原产物,故还原性Cl-<Fe2+,故A错误;
B、一般物质的熔点为原子晶体>离子晶体>金属晶体>分子晶体,Al2O3是离子晶体,而Al是金属晶体,故熔点Al2O3>Al,故B正确;
C、Fe(OH)2有很强的还原性,极易被氧化为Fe(OH)3,故稳定性弱于Fe(OH)3,故C错误;
D、Al(OH)3为沉淀,碱性极弱,而一水合氨是常用的弱碱,即碱性Al(OH)3<NH3•H2O,故D错误.
故选B.
点评 本题考查了常见物质的氧化性、还原性的强弱比较以及物质的熔点、稳定性等的强弱比较,难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
19.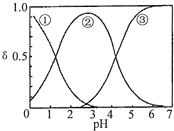 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1 mol•L-1 NaHC2O4溶液中:c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(Ca2+)不变,c(C2O42-)将减小.(CaC2O4难溶于水) |
20.设NA为阿伏加德罗常数的值,则下列说法不正确的是( )
| A. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| B. | 1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8NA | |
| C. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
19.合金是一类用途广泛的金属材料,下列物质中属于合金的是( )
| A. | 钢 | B. | 水银 | C. | 金刚石 | D. | 四氧化三铁 |
4.有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数( )
| A. | 52.4% | B. | 30% | C. | 70% | D. | 47.6% |
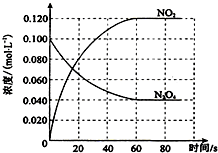 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.