��Ŀ����
����Ŀ��A��B��C����ѧ��ѧ�������������ʣ�����֮����ת����ϵ���£����ַ�Ӧ������������ȥ���� A ![]() B
B ![]() C
C
��1����A��һ�ֻ�ɫ���ʹ��壬��B��C�Ļ�ѧ����ʽΪ ��
��2����A��һ�ֻ��ý�����C�ǵ���ɫ���壬���û�ѧ����ʽ��ʾC�������̼����ķ�Ӧ �� ��C����¶���ڿ����У���������D��D�Ļ�ѧʽΪ �� ����D��NaHCO3�Ĺ�������10.0g���������������ٸı䣬ʣ���������Ϊ9.38g��D����������Ϊ ��
��3����C�Ǻ���ɫ���壬��ͼ��ʵ������ȡA�����װ�ã�������ѧ֪ʶ���ش��������⣺ 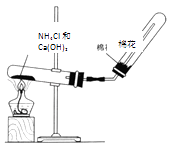
����д����A��B�Ļ�ѧ����ʽ ��
����֤A�Ƿ��Ѿ��ռ����ķ���������дһ�֣���
��д����ҵ����ȡA�Ļ�ѧ����ʽ ��
��C��ˮ��Ӧ�ɵõ���X��Ҫʹ1molCǡ����ȫת��ΪX����ͨ�����������ʵ���Ϊ ��
���𰸡�
��1��2SO2+O2![]() 2SO3
2SO3
��2��2Na2O2+2CO2=2Na2CO3+O2���� Na2CO3��83.2%
��3��4NH3+5O2![]() NO+6H2O����ʪ��ĺ�ɫʯ����ֽ�����Թܿڴ�,����ֽ����,��֤���������ռ���������պ��Ũ����IJ����������Թܿڴ�,��������������,��֤���������ռ������� N2+3H2
NO+6H2O����ʪ��ĺ�ɫʯ����ֽ�����Թܿڴ�,����ֽ����,��֤���������ռ���������պ��Ũ����IJ����������Թܿڴ�,��������������,��֤���������ռ������� N2+3H2![]() 2NH3��0.25mol
2NH3��0.25mol
���������⣺��1����A��һ�ֻ�ɫ���ʹ��壬��A��S���ʣ�����B�Ƕ�������C������������B��C�Ļ�ѧ����ʽΪ2SO2+O2 ![]() 2SO3��
2SO3��
���Դ��ǣ�2SO2+O2 ![]() 2SO3����2����A��һ�ֻ��ý�����C�ǵ���ɫ���壬��AΪNa��BΪNa2O��CΪNa2O2��C����¶���ڿ����У�����ϵ�б仯����������D��DΪNa2CO3��������������CO2��Ӧ����̼��������������Ӧ�Ļ�ѧ����ʽ��2Na2O2+2 CO2=2 Na2CO3+O2����
2SO3����2����A��һ�ֻ��ý�����C�ǵ���ɫ���壬��AΪNa��BΪNa2O��CΪNa2O2��C����¶���ڿ����У�����ϵ�б仯����������D��DΪNa2CO3��������������CO2��Ӧ����̼��������������Ӧ�Ļ�ѧ����ʽ��2Na2O2+2 CO2=2 Na2CO3+O2����
��������̼�����Ƶ�����Ϊm����
2NaHCO3 | �������� |
168 | 62 |
m | 10g��9.38g=0.62g |
��m= ![]() =1.68g����̼���Ƶ���������=
=1.68g����̼���Ƶ���������= ![]() ��100%=83.2%��
��100%=83.2%��
���Դ��ǣ�2Na2O2+2 CO2=2 Na2CO3+O2����Na2CO3��83.2%����3����C�Ǻ���ɫ���壬A������һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��AΪNH3��BΪNO��CΪNO2��
�ٰ����ڴ������¿���������Ӧ����NO������ʽΪ4NH3+5O2 ![]() NO+6H2O�����Դ��ǣ�4NH3+5O2
NO+6H2O�����Դ��ǣ�4NH3+5O2 ![]() NO+6H2O��
NO+6H2O��
��AΪ��������������ˮ���ܶȱȿ���С�����������ſ������ռ������鰱���Ƿ��ռ������ɽ�ʪ��ĺ�ɫʯ����ֽ�����Թܿڴ�������ֽ��������֤���������ռ��������ð�ɫ�ķ�̪��ֽ�����Թܿڴ�������ֽ��죬��֤���������ռ�����Ҳ������պ��Ũ����IJ����������Թܿڴ����������������̣���֤���������ռ�����
���Դ��ǣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿڴ�������ֽ��������֤���������ռ���������պ��Ũ����IJ����������Թܿڴ����������������̣���֤���������ռ�������
�۹�ҵ���õ����������ڸ��¸�ѹ�£����������Ʊ�����������ʽΪN2+3H2 ![]() 2NH3�����Դ��ǣ�N2+3H2
2NH3�����Դ��ǣ�N2+3H2 ![]() 2NH3��
2NH3��
�ܶ���������������Ӧ�������ᣬ����ʽΪ4NO2+O2+2H2O=4HNO3���ɷ���ʽ��֪1mol����������0.25mol������Ӧ�����Դ��ǣ�0.25 mol��

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�����Ŀ��ij��ȤС����Ƴ���ͼ��ʾװ�������С�ͭ�����ᷴӦ��ʵ�飬��̽����ѧʵ�����ɫ���� 
��1��ʵ��ǰ���رջ���b���Թ�d�м�ˮ����û�����ܿڣ������Թ�c��d�Ľ���������c����Ŀ���� ��
��2����d�м�����NaOH��Һ��c�з�һС��ͭƬ���ɷ�Һ©��a��c�м���2mLŨ���ᣬc�з�Ӧ�Ļ�ѧ����ʽ�� �� ����a��c�м�2mL����ˮ��c�е�ʵ�������� ��
��3���������ȡ����ͭ�����ַ�������������ɫ��ѧ�������ѷ����� �� �������� ��
�� �� | �� Ӧ �� |
�� | Cu��ŨHNO3 |
�� | Cu��ϡHNO3 |
�� | Cu��O2��ϡHNO3 |
��4����С�黹������װ�ý���ʵ��֤��������KMnO4��Cl2��Br2 �� ��������Ϊ��ʵ������Ϊ ��