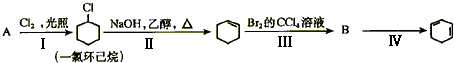
题目内容
某有机物X由C、H、O三种元素组成,X的沸点是471K。已知:①在一定温度和压强下,在密闭容器中把4.2LX的蒸气和18.9LO2(过量)混合点燃,充分反应后将温度和压强恢复到原来状态,得混合气体A 29.4L(另知该状态下1 mol气体的体积为42L)。②当A处于标准状况时,气体体积变为8.96L,此时测得气体的密度为1.696g×L-1。试根据计算判断:
(1)A中各组分的物质的量(答案保留2位有效数字)。
(2)X的分子式。
(3)若X分子中不存在—O—O—键,试写出X所有可能的结构简式。
答案:
解析:
解析:
| (1)CO2:0.2mol;H2O:0.3mol;O2:0.2mol (2)C2H6O2
(3)HO—CH2—CH2—OH或HO—CH2—O—CH3 (1)①n(H2O)= ②设A中CO2和O2的物质的量分别为x和y,则有:
解得x=0.2mol,y=0.2mol (2)又设X的分子式为CmHnOg
故x的分子式为C2H6O2。 (3)由于X分子中氢原子数是饱和的。故分子中不存在环或不饱和键,故分子的骨架有(不考虑—O—O—): O—C—C—O和O—C—O—C,补足H原子后得结构简式为HO—CH2—CH2—OH和HO—CH2—O—CH3。
|

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目


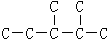 ,此烷烃的一溴代物有
,此烷烃的一溴代物有