题目内容
9.几种中学化学常见的单质及其化合物相互转化的关系图如下:
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物.
②A是黄铁矿的主要成分.
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料.
试根据上述信息回答下列问题:
(1)A的化学式为FeS2,每反应1mol的A转移的电子数为11 mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方式:Fe+2Fe3+=3Fe2+;
(3)少量F的饱和溶液与分别滴加到下列物质中,得到以下三种分散系①、②、③.

试将①、②、③填入下列方框中:

(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子.试写出M在酸性环境下将G氧化为F的离子方程式:H2O2+2H++2Fe2+=2H2O+2Fe3+;
(5)已知丙单质与D的浓溶液按物质的量为1:2恰好反应生成B气体的化学转化式为:丙+D(浓)$\stackrel{△}{→}$B↑+丙的氧化产物+水则丙在其氧化产物中的化合价为:+4.
分析 由③中信息:B气体是引起酸雨的主要物质,则B为SO2,H常温下为无色无味的液体,则H为H2O;E常用作红色油漆和涂料,故E为Fe2O3,则A中应含Fe、S两种元素.由②可计算得到A的化学式为FeS2.再结合流程图可推知甲为O2,C为SO3,D为H2SO4.由E(Fe2O3)$\frac{乙}{高温}$丁(单质)可知,丁为Fe,D(H2SO4)+E(Fe2O3)→F,则F为Fe2(SO4)3,G为FeSO4,丙可以为S等,乙可以为碳或氢气等,据此解答.
解答 解:由③中信息:B气体是引起酸雨的主要物质,则B为SO2,H常温下为无色无味的液体,则H为H2O;E常用作红色油漆和涂料,故E为Fe2O3,则A中应含Fe、S两种元素.由②可计算得到A的化学式为FeS2.再结合流程图可推知甲为O2,C为SO3,D为H2SO4.由E(Fe2O3)$\frac{乙}{高温}$丁(单质)可知,丁为Fe,D(H2SO4)+E(Fe2O3)→F,则F为Fe2(SO4)3,G为FeSO4,丙可以为S等,乙可以为碳或氢气等,
(1)由上述分析可知,A的化学式为FeS2,高温下燃烧的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,由此分析可知,每消耗4 mol FeS2,转移电子为44 mol,即每反应1 mol的A(FeS2)转移的电子为11 mol,故答案为:FeS2;11;
(2)由转化关系图可知F为Fe2(SO4)3,丁为Fe,G为FeSO4,则有关的离子反应为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(3)少量饱和Fe2(SO4)3溶液加入①冷水中形成溶液,加入②NaOH溶液中会产生Fe(OH)3沉淀,形成浊液,加入③沸水中会产生Fe(OH)3胶体,即 ,
,
故答案为: ;
;
(4)化合物M与H(H2O)组成元素相同,则M为H2O2,M在酸性条件下将G(FeSO4)氧化为F[Fe2(SO4)3]的离子方程式为:H2O2+2H++2Fe2+=2H2O+2Fe3+,
故答案为:H2O2+2H++2Fe2+=2H2O+2Fe3+;
(5)已知丙单质为S与D为H2SO4的浓溶液按物质的量为1:2恰好反应生成B气体为SO2,化学转化式为:丙+D(浓)$\stackrel{△}{→}$B↑+丙的氧化产物+水,浓硫酸被还原为SO2,S+2H2SO4=3SO2↑+2H2O,则S被氧化为SO2,则丙在其氧化产物中的化合价为+4价,
故答案为:+4价.
点评 本题考查无机物推断,注意根据物质的性质进行推断,需要学生熟练掌握元素化合物知识,侧重是对基础知识的综合应用的考查,难度较大.

 已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=4.7×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(HR)×c(O{H}^{-})}{c({R}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
| A. | 2mol/LAgNO3溶液 | B. | 2mol/LNaOH溶液 | C. | 2mol/LMgSO4溶液 | D. | Fe(OH)3胶体 |
| A. | 常温常压下,2.8 g N2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12L O2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L 0.1mol/L 的NH4NO3溶液中氧原子数为0.3NA |
| A. | 盐 | B. | 氧化物 | C. | 单质 | D. | 有机物 |

 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.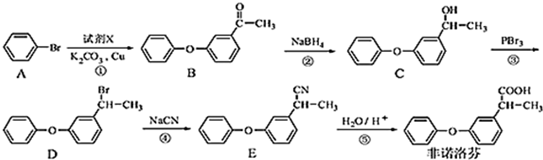
 .
. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.