题目内容
将3molN2和4molH2在适宜条件下按下式反应:N2+3H2?2NH3在某一温度下达到化学平衡状态.试回答:
若测得N2与H2的平衡浓度相等,求NH3在平衡混合气中的物质的量分数.
若测得N2与H2的平衡浓度相等,求NH3在平衡混合气中的物质的量分数.
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,设氮气消耗物质的量为x;
N2+3H2?2NH3
起始量(mol) 3 4 0
变化量(mol) x 3x 2x
平衡量(mol)3-x 4-3x 2x
若测得N2与H2的平衡浓度相等,则物质的量相同则,3-x=4-3x
x=0.5mol;
据此分析计算.
N2+3H2?2NH3
起始量(mol) 3 4 0
变化量(mol) x 3x 2x
平衡量(mol)3-x 4-3x 2x
若测得N2与H2的平衡浓度相等,则物质的量相同则,3-x=4-3x
x=0.5mol;
据此分析计算.
解答:
解:依据化学平衡三段式列式计算,设氮气消耗物质的量为x;
N2+3H2?2NH3
起始量(mol) 3 4 0
变化量(mol) x 3x 2x
平衡量(mol)3-x 4-3x 2x
若测得N2与H2的平衡浓度相等,则物质的量相同则,3-x=4-3x
x=0.5mol;
NH3在平衡混合气中的物质的量分数=
×100%=
×100%=16.7%
答:NH3在平衡混合气中的物质的量分数16.7%.
N2+3H2?2NH3
起始量(mol) 3 4 0
变化量(mol) x 3x 2x
平衡量(mol)3-x 4-3x 2x
若测得N2与H2的平衡浓度相等,则物质的量相同则,3-x=4-3x
x=0.5mol;
NH3在平衡混合气中的物质的量分数=
| 2x |
| 3-x+4-3x+2x |
| 2×0.5 |
| 7-2×0.5 |
答:NH3在平衡混合气中的物质的量分数16.7%.
点评:本题考查了化学平衡计算方法应用,注意物质的量之比和浓度之比关系,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
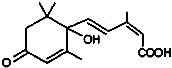 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )| A、含有碳碳双键、羟基、羰基、羧基 |
| B、能发生加成反应、氧化反应、取代反应、缩聚反应 |
| C、1mol该分子能与含2mol NaOH的溶液完全反应 |
| D、该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4mol Br2反应 |
下列离子方程式正确的是( )
| A、醋酸溶解水垢(主要成分是碳酸钙)CaCO3+2H+→CO2↑+Ca2++H2O | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|
汽车尾气(含有烃类、CO、NOx、SO2)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”,它使CO和NOx反应生成可参与大气生态环境循环的无毒气体,并使烃类充分燃烧及SO2转化,下列说法错误的是( )
| A、CO和NOx反应的化学方程式为:2xCO+2NOx=2xCO2+N2 |
| B、上述方法的缺点是由于CO2增多,会大大提高空气的酸度 |
| C、多植树造林,增大绿化面积,可有效控制城市空气各种污染源 |
| D、汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染 |
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间) :
: :
: :
: :
: 硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:
硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题: